(15分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、4mol CH4,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 |
CH4 |
CO2 |
CO |
H2 |
| 平衡浓度(mol·L-1) |
0.5 |
1.0 |
1.0 |
1.0 |
①在该条件下达平衡时,CH4的转化率为____________________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2(g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
求反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的 △H=_______________kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______________kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4 CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,
CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,
请回答下列问题:
①250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
②为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
(3)Li4SiO4可用于吸收、释放CO2,原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反应方向和逆反应方向的条件): 。
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 |
Na |
S |
Al2O3 |
| 熔点/℃ |
97.8 |
115 |
2050 |
| 沸点/℃ |
892 |
444.6 |
2980 |
a.100℃以下 b.100℃~300℃ c.300℃~350℃ d.350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx =" 2Na" + xS(3<x<5),则阳极的电极反应式为 .
(12分)高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是____________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有________(填化学式)。“电解Ⅱ”的化学方程式为__________________________________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为______________。
“气流干燥”时,温度控制在80~100 ℃的原因是________________________。
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第四周期第ⅠB 族。Cu2+的核外电子排布式为。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为。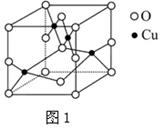
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图2:下列说法正确的是(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:。
(5)Cu2O的熔点比Cu2S的(填“高”或“低”),请解释原因:。
(6)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________
(7)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
(选考)某磷肥厂利用某磷矿石[Ca3(PO4)2]制取磷肥并综合利用副产物生产水泥的工艺流程如下: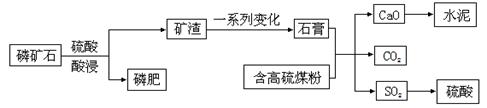
(1)将磷矿石制成磷肥的目的是,有关的化学方程式为。
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是。
(3)水泥属于材料。
(填“A”或者“B”:A.新型无机非金属材料 B.传统无机非金属材料)
(4)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则该热化学方程式为,平衡常数K为。
(5)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。若98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,则a=,b=。
Ⅰ.在含有弱电解质的溶液中,往往有多个化学平衡共存。一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入少量CH3COONa固体。
(1)CH3COOH溶液的电离平衡移动(填“向左”、“向右”或“不”),溶液中 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若该溶液呈酸性,则溶液中各离子浓度由大到小的顺序为:。
Ⅱ、开发新能源和三废处理都是可持续发展的重要方面。
(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则该合成甲醇的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为;P1P2(填“>”或“<”或“=”);
M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总=。
(15分)某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如下: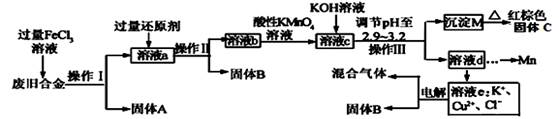
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是。
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是,溶液a中发生的反应的离子方程式为。
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至。
(6)工业上由红棕色固体C制取相应单质常用的方法是。
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为。