某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀盐酸,测得反应放出气体的总质量与所加入稀盐酸的质量关系曲线如图所示,请回答: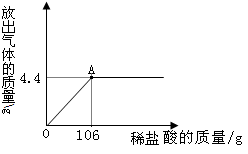
(1)当加入212g稀盐酸时,放出气体的质量为__________g
(2)碳酸钠样品中碳酸钠的质量分数为多少?(写出计算过程)
(3)加入106g稀盐酸(即A点)时烧杯中溶液溶质的质量分数为多少?(写出计算过程)
人体胃液中含少量HCl,正常情况下胃液的pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃酸过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.495%(胃液密度约为1g/cm3).
(1)若人的胃液总量约为100mL,请完成下列表格:
| 正常情况下胃液中HCl的质量范围 |
|
| 该患者胃液中HCl的质量 |
|
| 该患者至少要除去的HCl的质量是 |
(2)医生给该患者开了一瓶胃舒平(每片含氢氧化铝0.39g),并要求病人每次服用2片,请根据化学方程式计算在食用该药片后被出去的HCl的质量是多少?(发生反应的化学方程式为Al(OH)3+3HCl==AlCl3+H2O)
医生还提醒该胃药不宜过量服用,可能原因是。(答一点即可)
国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL( 总酸含量即100mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋和氢氧化钠反应的化学方程式:CH3COOH+NaOH====CH3COONa+H2O假设该市售食
总酸含量即100mL食醋中含醋酸的质量)。某兴趣小组为测定一市售食醋的总酸含量,进行了实验。实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应。计算该市售食醋样品中的总酸含量,并说明是否符合国家标准。(食醋和氢氧化钠反应的化学方程式:CH3COOH+NaOH====CH3COONa+H2O假设该市售食 醋样品中其它物质不与氢氧化钠发生反应)
醋样品中其它物质不与氢氧化钠发生反应)
请根据下图所示的实验过程和提供的数据,计算样品中钠元素的质量。
已知:

氢化锂(
)为玻璃状无色透明固体,军事上用作氢气发生来源,反应的化学方程式为:
↑。计算80
氢化锂与足 量的水反应生成氢气的质量。
量的水反应生成氢气的质量。
乙醇是一种清洁燃料,但在氧气不足燃烧,会生成一氧化碳。现有 乙醇与一定量的氧气点燃后发生如下反应:
(1)据质量守恒定律可知:
;
⑵计算该反应生成的一氧化碳的质量。