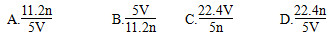下图是模拟电化学反应的装置图,下列有关叙述中,不正确的是
| A.若a为铜棒,b为锌棒,X为CuSO4溶液,开关C置于B处,可以实现锌表面镀铜 |
| B.若a 为碳棒,b为铁棒,X为NaCl溶液,开关 C置于B处,可减缓铁的腐蚀,该法称为外加电流的阴极保护法 |
| C.若a为锌棒,b为铁棒,X为经过酸化的3%的氯化钠溶液,开关C置于A处,一段时间后向b极区滴入几滴K3[Fe(CN)6](铁氰化钾)溶液,不能观察到有蓝色沉淀生成 |
| D.若a为铜棒,b为铝棒,X为浓硝酸溶液,开关C置于A处,铝棒质量将减少,铜电极发生的电极反应式为2H++2e-=H2↑ |
下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl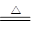 Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3—+Ca2++OH-=CaCO3↓+H2O |
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是( )
| A.所得沉淀为0.05 mol的BaSO4 |
| B.混合气体中SO2的体积为0.448 L |
| C.a L混合气体的物质的量为0.04 mol |
| D.a的取值范围为0.672<a<0.896 |
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(每次加入的盐酸的物质的量浓度相等),下列分析正确的是( )
| 盐酸/mL |
50 |
50 |
50 |
| m(混合物)/g |
9.2 |
15.7 |
27.6 |
| V(CO2)(标准状况)/L |
2.24 |
3.36 |
3.36 |
A.盐酸的物质的量浓度为3.2 mol·L-1
B.混合物中NaHCO3的质量分数为54.3%
C.9.2 g混合物中KHCO3的物质的量为0.05 mol
D.15.7 g混合物恰好与盐酸完全反应
将标准状况下的某气体(摩尔质量为M g/mol)溶于a g水中,所得溶液的密度为b g/cm3,物质的量浓度为c mol/L,则溶入水中的该气体体积是( )
A.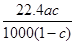 L L |
B.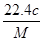 L L |
C.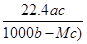 L L |
D.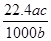 L L |
工业上将氨气和空气的混合气体通过铂—铑合金网发生氨氧化反应,若在标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )