(16分)氮及其化合物在工农业生产中具有重要作用,人工固氮是指将氮元素由游离态转化为化合态的过程。
(1)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g) 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”;向另一电极通入N2,该电极的反应式为__________________________。
(2)目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol。某小组进行工业合成氨的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H=-93.0kJ/mol。某小组进行工业合成氨的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。

实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若制取27g ClO2,则反应中转移电子的物质的量是 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。
请回答下列问题:
⑴ C的分子式为 ,J的电子式为 。
⑵ 写出反应①的离子方程式 。
⑶ 写出反应②的化学方程式 。
⑷C、M有相似的化学性质,但也有区别,如C有漂白性、M五漂白性。C、M具有其他不同化学性质的原因是 。
某有机化合物D,其相对分子质量为166,取8.3g该物质完全燃烧得到CO2与H2O的物质的量之比是9:5。回答下列问题:
(1)D的分子式为:;
(2)已知其分子结构中含有一个苯环,苯环的两个邻位有取代基。进一步实验可知:
①D能与碳酸氢钠溶液反应生成无色无味气体。②8.3gD物质与足量金属钠反应可生成氢气1.12L(标准状况)。③D不能与FeCl3溶液发生显色反应。④D不能发生消去反应。请写出符合上述条件的D的所有同分异构体的结构简式:
(3)已知D的一种同分异体有以下转化关系。取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀。E分子中有两个六元环结构。
①A的结构简式为;
②上述转化过程中涉及到的反应类型有(填选项);
| A.氧化反应 | B.加成反应 | C.取代反应 | D.聚合反应 |
③写出由A→B的化学方程式:;
写出由D→E的化学方程式:。
某研究性学习小组从网上查到绿矾(FeSO4·7H2O)受热分解的方程式为:
2FeSO4·7H2O Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。
Fe2O3+SO3↑SO3↑+14H2O↑,就设计了如下实验装置来验证绿矾受热分解是否发生上述反应。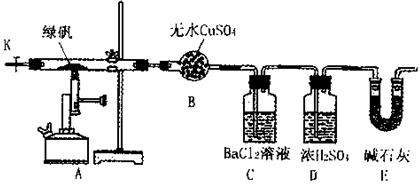
主要实验步骤如下:
①组装仪器并检查装置的气密性;
②称量绿矾样口及U型干燥管E的质量,将称量后的绿矾置于硬质玻璃管内;
③关闭活塞K,加强热使绿矾完全分解;
④打开活塞K,缓缓鼓入一定量的氮气;
⑤再次称量干燥管E的质量;
⑥重复④⑤的操作,直到干燥管E的质量基本不变为止;
⑦称量洗气瓶C中所得沉淀的质量。
试回答:
(1)洗气瓶D中浓H2SO4的作用为:;
(2)步骤⑦从溶液中获取生成沉淀质量的具体操作为:;
(3)实验小组的报告如下,请补充完整:
| 实验记录 |
分析或计算结果 |
|
| 现象 |
硬质管内绿色变为红棕色; |
生成物有 |
| 干燥管B中晶体白色变蓝色。 |
生成物有H2O |
|
| 数据 |
称取绿矾样品16.68g; |
反应的绿矾0.06mol |
| 干燥管E最后增重2.24g; |
生成SO2mol |
|
| C中生成白色沉淀的质量为4.66g; |
生成DO3 0.02mol |
(4)该实验所得到的数据与所样到的化学方程式中的定量关系不相符合,请分析可能的原因。
(5)为达到“验证绿矾受热分解是否发生上述反应”的目的,该实验的设计有多处不妥,请提出改进建议(两条即可)
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图:;由C、A两种元素形成的18电子化合物的电子式为;
(2)工业上制取E单质的化学方程式为:;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有和(填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式:;
(5)下图是中学常见的几种晶体结构。有关说法正确的是(填选项)。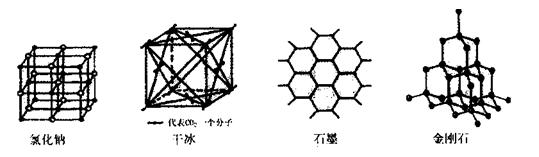
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
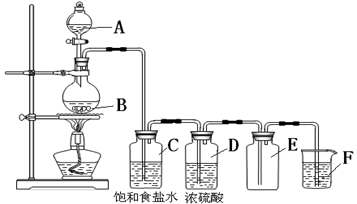
以下是实验室制取氯气的装置,在图中饱和食盐水的作用是,
浓硫酸的作用是,F中盛放的溶液是,起的作用是。