橙皮素具有抗氧化、消炎、降血脂、保护心血管和抗肿瘤等多种功效。它的合成路线如下:
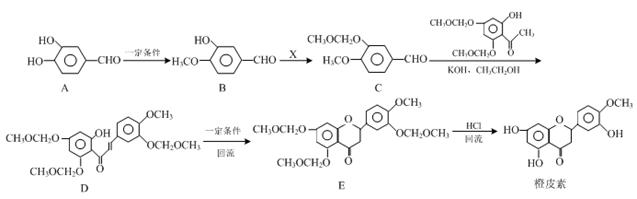
(1)化合物A中的含氧官能团有 、 (填官能团名称)。
(2)已知:B→C为取代反应,其另一产物为HCl,写出X 的结构简式: 。
(3)反应D→E的反应类型是 。
(4)写出同时满足下列条件的B的同分异构体的结构简式: 。
Ⅰ.属于芳香族化合物;
Ⅱ.分子中有4种不同化学环境的氢;
Ⅲ.不能与FeCl3溶液发生显色反应,但能发生水解反应。
(5)已知: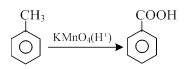
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备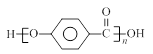 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
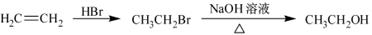
五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E的最外层电子数之和为8。回答下列问题:
(1)五种元素中,原子半径最大的是________(填元素符号)。
(2)由A和B、D所形成的共价型化合物中,热稳定性较差的是________(用化学式表示),理由是。熔沸点较高的是(用化学式表示),理由是。
(3) A和B所形成的共价型化合物的几何构型为。
(4) A和E形成的化合物与A和B形成的化合物反应,产物的电子式为________。
(5)单质E与水反应的离子方程式为_______________________________________。
A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A_______,B_______,C_______。
(2)化合物C2A的电子式是______________,BA2的结构式是:_______________。
(3)A、C的最高价氧化物对应的水化物之间的离子反应方程式为。
随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9 mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为;
A.2 sB.3 sC.4 sD.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂3 mol H-H键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
现有①NaCl②金刚石 ③Na ④NaHSO4⑤干冰 ⑥碘片六种物质,按要求回答下列问题(填序号):
(1)属于离子化合物的是,只有离子键的物质是,晶体以分子间作用力结合的是。
(2)NaHSO4熔融状态下电离,破坏了键,写出电离方程式
(3)判断①、②、③、⑤熔沸点高低顺序
将下列物质进行分类(填序号)
①O2与O3 ②126C与136C ③白磷与红磷
④冰与水⑤H2、D2、T2 ⑥乙醇与二甲醚
⑦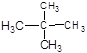 和
和
(1)互为同位素的是(2)互为同素异形体的是
(3)互为同分异构体的是(4)属于同一化合物的是