(15分)三氯氧磷(POCl3)无色液体,易水解。用于制取染料中间体,有机合成的氯化剂和催化剂,阻燃剂。还常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)在反应釜中氯化水解法生产三氯氧磷的化学方程式为 。反应中应控制氯气和水的质量比为3.94,若质量比过小,会导致三氯氧磷产率降低,试分析原因 。
(2)经吸收塔吸收后得到副产品,副产品为 (写名称)。
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
(4)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水,某研究小组想把含磷废水中磷元素转化为磷酸钙沉淀除去,实验操作为 。
可选用的试剂:漂白粉 生石灰 氯化
| |
最佳沉淀pH |
| 磷酸氢钙 |
7.0——7.6 |
| 磷酸钙 |
9.0——11 |
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:;若反应过程中有2 mol电子发生转移,会有g Cu溶解。
(2)某工程师为了从使用过的腐蚀废液(不含FeCl3)中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤: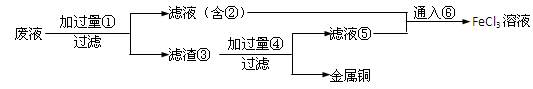
请写出上述试验过程中②⑤的化学式:
②,⑤。
请写出①⑥两步反应的离子方程式:;
。
已知: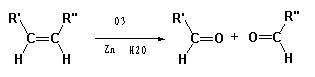
某一元氯代烃A分子式为C6H11Cl,可以发生如下图所示的转化: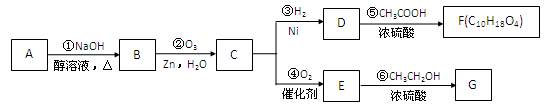 结构分析表明F分子中含有两个甲基。请回答下列问题:
结构分析表明F分子中含有两个甲基。请回答下列问题:
(1)G的分子式为_____________。
(2)写结构简式:A________________________,E_____________________。
(3)A→B的反应方程式是____________________________________________。
D→F的反应方程式是____________________________________________。
(4)F 和 G____________(是或否)互称为同分异构体。
(10分)某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0 g铝片放入圆底烧瓶中,然后通过分液漏斗加入500 mL 0.5 mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示) ,请你帮助该小组同学回答下列问题: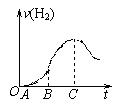
(1)曲线OA段不产生氢气的原因是_____________ _ ______
____________________ _____,
有关的离子反应方程式为______________________________ _____
(2)曲线BC段产生氢气的速率突然加快的主要原因是
____________________________________________________________________________
(3)点C以后产生氢气的速率逐渐减小的主要原因是
____________________________________________________________________________
(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)___________
某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B;沉淀C;沉淀D;溶液E。
(3)写出①、②、③、④四个反应方程式(②、③写离子方程式①、④写化学方程式)
①;②;
③;④。
下表标出的是元素周期表的一部分元素,回答下列问题:
| 1 |
||||||||||||||||||
| 2 |
D |
B |
A |
|||||||||||||||
| 3 |
J |
I |
H |
C |
G |
F |
E |
|||||||||||
| 4 |
L |
K |
N |
|||||||||||||||
| 5 |
M |
|||||||||||||||||
| 6 |
(1)表中用字母标出的14种元素中,化学性质最不活泼的是(用元素符号表示,下同),非金属性最强的是,常温下单质为液态的非金属元素是.J、C、F中,原子半径最小的元素是;属于过渡元素的是(该空用字母表示),第六周期的元素共有种。
(2)F,C气态氢化物中其中以(填化学式)最不稳定;第三周期对应的碱性最强的最高价氧化物的水化物的化学式是,该物质含有的化学键类型是,用该物质做焰色反应实验,火焰呈色。
(3)N元素在周期表中的位置是,写出由F单质制取N单质的离子方程式是。