(共18分)随着电子工业的发展,电子废料和电子废料逐步增多,这些电子废料和垃圾常常含有重要金属元素,具有回收价值,如一种含铝、锂、钴的新型电子材料,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:

(1)金属铝的化学性质活泼,但铝箔在空气中能稳定存在,原因是 ,则步骤I加碱后铝箔首先发生的反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) ,若消耗0.2molNa2S2O3,转移电子数目为 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)工业制取的Na2CO3常常含有NaHCO3杂质,下列各说法正确的是______(填序号)。
| A.可采用加热的方法除去Na2CO3固体中的NaHCO3杂质 |
| B.向某无色溶液中滴加稀盐酸,生成无色无味的气体,通入澄清石灰水变浑浊,则溶液一定含有CO32‾ |
| C.实验室有两瓶失去标签的试剂,分别为Na2CO3溶液和稀盐酸,不用其它试剂即可鉴别 |
| D.可用Ca(OH)2鉴别Na2CO3与NaHCO3 |
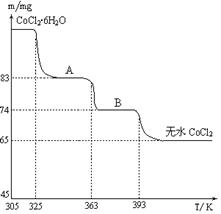
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)= Na3AlH6 (s)+
Na3AlH6 (s)+ 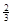 Al (s) + H2(g)ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g)ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) +  H2(g)ΔH=+ 70.5 kJ·molˉ1
H2(g)ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) + H2(g)ΔH=。
H2(g)ΔH=。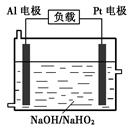
(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为。
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)_______;此时,混合溶液中由水电离出的c(H+)___ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系__________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
(1)某温度下,纯水中c [H+]=2.0×10-7 mol/L,则此时c [OH-] =mol/L,水的离子积Kw=;相同条件下,测得① Na2CO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。那么,它们的物质的量浓度由大到小的顺序是。
(2)pH值相同的 HCl(aq)、H2SO4(aq)、 CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是;
②分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是。
③反应开始时,反应速率。(从下面选项中选择填写)
| A.HCl最快; | B.H2SO4最快; | C.CH3COOH最快; | D.一样快 |
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-)c (H+)②c (HCN)c (CN-)
(4)①Na2CO3溶液的pH 7(填“>、<、=”),
其原因是(用离子方程式表示)
②若溶液Na2CO3溶液和Al2(SO4)3溶液混合,观察到有白色絮状沉淀和无色气体生成,该反应的离子方程式为
(5)下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数(mol2·L-2) |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
①若25<t1<t2,则a__________1×10-14 mol2·L-2(填“>”、“<”或“=”),做此判断的理由是________________________。
②25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
③t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是____________。
在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:(1)2 min末SO3的浓度;(2)2 min内SO2的平均反应速率(3)2 min末SO2与O2的压强的比。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:AB CDE
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
(3)写出A的最高价氧化物的水化物与B最高价氧化物反应的离子方程式:
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)