I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
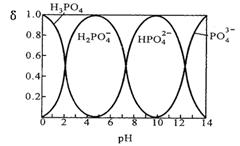
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na2HPO4溶液中,c(Na+)/c(HPO42—) 2(填“>”“=”“<”);向该溶液中滴入几滴浓NaOH溶液后,c(Na+)/ c(HPO42—)的值增大,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=9.0条件下,反应前10min内磷酸的沉淀速率 。

II.在某温度下,把4.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下:
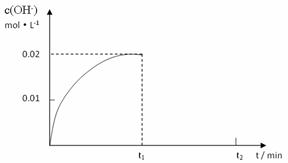
①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
(1)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。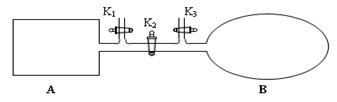
①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
(2)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。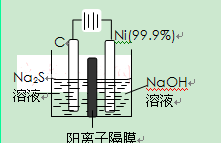
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,
则阴极的电极反应式是:。
当反应转移xmol电子时,产生的气体体积为(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在
氮气气氛下溶解。其原因是(用离子反应方程式表示):。
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为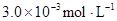 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 |
平衡常数 |
焓变 |
起始总浓度 |
在水中,HA 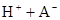 |
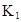 |
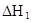 |
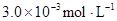 |
在苯中,2HA 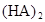 |
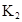 |
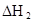 |
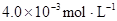 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则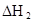 ___________0。
___________0。
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足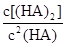 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。
下图是中学化学某些物质之间在一定条件下的相互转化关系,已知A是一种常见的液态化合物, C、D、G、H、K是单质,其它为化合物,G、K是普通钢中的两种重要元素,其中K含量少,E、F对应溶液的酸碱性相反,F的焰色反应为黄色,请按要求作答: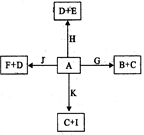
(1)写出化合物J的电子式:_______________。
(2)G3+比G2+的稳定性的原因,组成D、H、K三种元素的第一电离能由大到小的顺序为(写元素符号)。A分子中心原子的杂化方式为,A可与Cu2+形成天蓝色的物质,画出该离子的结构示意图,写出一种与化合物I 为等电子体关系的阴离子
(3)B与足量稀硝酸反应,当参加反应的硝酸为4mol,转移电子的物质的量为 _________mol(保留2位有效数字)。
(4)已知在200℃,101Kpa下,0.12g单质K与A完全反应生成C与I,吸收了1316 J的能量,写出此反应的热化学方程式:_________________________。
(5)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的电极反应为:___________。
②若用此电池电解300mL 5mol/L的氯化钠溶液一段时间,两极均收集到标准状况下3.36L气体,此时溶液的pH为_________(假设电解前后溶液体积不变化)。
③若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),此时溶液中所有离子浓度的关系由大到小的顺序为:_______________________
25℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
H2C4H4O6(酒石酸) |
H2SO3 |
| 电离平衡常数 |
2.0×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
K1=9.1×10-4 K2=4.3×10-5 |
K1=1.3×10-2 K2=6.3×10-8 |
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是(填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH=(已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+) =c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)=c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)=c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)=。(用准确的数值表示)
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下: 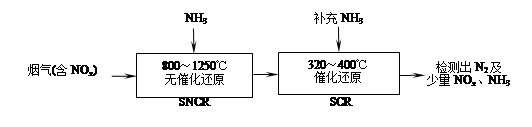
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
①4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)ΔH=-1627.2kJ•mol-1;
4N2(g)+6H2O(g)ΔH=-1627.2kJ•mol-1;
②6NO(g)+4NH3(g) 5N2(g)+6H2O(g)ΔH=-1807.0 kJ•mol-1;
5N2(g)+6H2O(g)ΔH=-1807.0 kJ•mol-1;
③6NO2(g)+8NH3(g) 7N2(g)+12H2O(g)ΔH=-2659.9 kJ•mol-1;
7N2(g)+12H2O(g)ΔH=-2659.9 kJ•mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH=kJ•mol-1。
2NO(g)的ΔH=kJ•mol-1。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。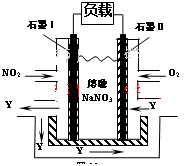
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-。
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式:。
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气L。