.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: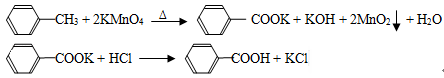
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
将白色固体B加入水中,加热溶 解, |
得到白色晶体和无色溶液 |
----------------- |
| ② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl— |
| ③ |
干燥白色晶体, |
熔点为122.4℃ |
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数为 (保留二位有效数字)。
磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O1010C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
该实验的目的是______________________________________________;表中V2=___________mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是
(5分)在实验室我们可以用如右图所示的装置制取乙酸乙酯。完成下列问题: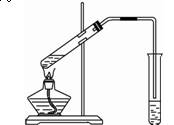
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:__________________________。
(2)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止______________________。
(3)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____________。
(4)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) _________________。
①单位时间里,生成1 mol乙酸乙酯,同时生成1 mol水
②单位时间里,生成1 mol乙酸乙酯,同时生成1 mol乙酸
③单位时间里,消耗1 mol乙醇,同时消耗1 mol乙酸
④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度相等
根据要求完成下列各小题实验目的。
(a、b为弹簧夹,加热及固定装置已略去)
(1)验证碳、硅非金属性的相对强弱。
(已知酸性:亚硫酸>碳酸)
① 连接仪器、、加药品后,
打开a关闭b,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是。
装置A中试剂是。③ 能说明碳的非金属性比硅强的实验现象是。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)①操作后打开b,关闭a。② H2S溶液中有浅黄色浑浊出现,化学方程式
是___________________________。
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
写出其中SO2显示还原性生成沉淀的离子方程式___________________________。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_______ __(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪 器除天平、药匙、玻璃棒外还有________(填仪器名称)。
器除天平、药匙、玻璃棒外还有________(填仪器名称)。
(3) 电解饱和食盐水的装置如图所示,
若收集的H2为2 L,
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是_____________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗 涤、烘干、称量.洗涤沉淀的操作是______________________________________
涤、烘干、称量.洗涤沉淀的操作是______________________________________
________________________________________________________________________.
方案二:气体 分析法
分析法
(2)把一定量的样品与足量盐酸反应后,用如图装置测定产生CO2气体的体积,为了测
定结果准确,B中的溶液最好采用________,但选用该溶液后实验结果仍然不够准确,
其原因是_______________________________________________________.
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度.
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g ②取n g样品装入广口
瓶中 ③检验装置的气密性
④缓慢鼓入空气数分钟,再称量干燥管质量为w g ⑤关闭止水夹 ⑥打开止水夹 ⑦
缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓入空气数分钟
Ⅰ.正确的操作顺序是(填写序号):
③→________→⑥→________→⑤→________→⑦→________→④
Ⅱ.若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”、
“偏小”或“无影响”).