AB、CD、EF均为1∶1型离子化合物,根据下列数据判断它们的熔点由高至低的顺序是
| |
AB |
CD |
EF |
| 离子电荷数 |
1 |
1 |
2 |
| 键长(10-10 m) |
2.31 |
3.18 |
2.10 |
A.CD>AB>EF B. AB>EF>CD
C.AB>CD>EF D.EF>AB>CD
下列各项表述正确的是
A.羟基的电子式: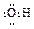 |
B.醛基官能团符号:—COH |
| C.乙醇的分子式:CH3CH2OH | D.异丁烷的结构简式:CH3CH(CH3)2 |
1993年的世界十大科技新闻称:中国学 者许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中1个分子由1134个碳原子和1146个氢原子构成。关于此物质,下列说法错误的是
者许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中1个分子由1134个碳原子和1146个氢原子构成。关于此物质,下列说法错误的是
| A.属于烃类 | B.常温下呈固态 |
| C.具有类似金刚石的硬度 | D.易被氧化 |
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是
A.分离、提纯→确定化学式→确定实验式→确定结构式
B.分离、提纯→确定实验式→确定化学式→确定结构式
C .分离、提纯→确定结构式→确定实验式→确定化学式
.分离、提纯→确定结构式→确定实验式→确定化学式
D.确定化学式→确定实验式→确定结构式→分离、提纯
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是
| A.二甲醚分子中只含有极性键 |
| B.二甲醚为不可再生能源 |
| C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式为:CH3OCH3 - 12e- + 12OH- = 2CO2 + 8H2O |
| D.二甲醚燃烧的热化学方程式表示为:CH3OCH3(g) + 3O2(g) = 2CO2(g) + 3H2O(g);△H =" -" 1455 kJ/mol |
八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图: 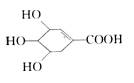
下列关于莽草酸的说法中正确的是
| A.该化合物既能发生消去反应,也能被催化氧化生成醛 |
| B.该化合物属于多元酚类物质,能使溴水褪色 |
| C.该化合物只有酸性,不具有碱性 |
| D.该化合物的分子中处于同一平面的原子只有4个 |