已知:(a)2H2(g)+O2(g)=2H2O(g) △H = -Q1
(b)2H2(g)+O2(g)=2H2O(1) △H = -Q2
(c)2CO(g)+O2(g)=2CO2(g) △H = -Q3
(1)Q1 (填>、=、<)Q2,因为 。
(2)CO和H2分别燃烧生成CO2和H2O(g),欲得到相同的热量,所需CO和H2的体积比是: 。
已知2A(g)+B(g)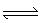 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C )="0.040" mol·L-1,放出热量Q1kJ。
)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是(填写序号);
a.v(C)="2v(B)" b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为(用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K=;
(4)已知:K(300℃)>K(350℃),该反应是(填“放”或“吸”)热反应;若反应温度升高,A的转化率(填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)K(B)(填“>”、“<”或“=”)。
A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如下表,且元素A的最高正化合价与最低负化合价的绝对值相差2,B与D属于同主族元素;元素C是一种银白色金属,放置在空气中会迅速被氧化成白色物质。
(1)D的原子结构示意图为 ;
;
(2)元素E在元素周期表中位于第 族;
族;
(3)C、D、E离子半径的大小关系为(用离子符号表示);
(4)元素B的单质与元素C的单质可发生化学反应生成化合物甲,则甲的化学式为
,实验证明甲能够与水发生化学反应,试写出甲与水反应的离子方程式
;
(5)若乙是元素A的最简单气态氢化物,丙是元素C的最高价氧化物对应的水化物。
①pH相同的乙丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,则xy(填写“>”、“<”或“=”=;
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,所发生反应的产 物不污染环境,其化学方程式为(不需要配平)。
物不污染环境,其化学方程式为(不需要配平)。
现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HC l溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
l溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=;
(2)丙溶液中存在电离平衡为
(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请 完成有关问题:
完成有关问题: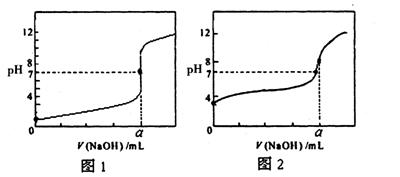
①甲溶液滴定丙溶液的曲线是(填“图1”或“图2”);
②a=mL。
硫酸和硝酸是中学阶段常见的两种强酸,请就两者与金属铜的反应情况回答下列问题:
(1)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是(填写代号):
| A.7.32L | B.6.72L | C.20.16L | D.30.24L |
(2)若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式。
今有①盐酸②硫酸③醋酸三种酸:
(1)在同体积,同PH的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(2)在同体积、同浓度的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(3)物质的量浓度为0.1 mol·L—1的三种酸溶液的PH由大到小的顺序是_____________;如果取等体积的0.1 mol·L—1的三种酸溶液,用0.1 mol·L—1的NaOH溶液中和,当恰好完全反应时,消耗溶液的体积由大到小的顺序是_______________(以上均用酸的序号填写)。