已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ),反应过程中能量变化如下图:请回答下列问题: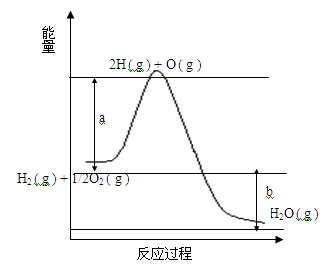
(1)图中a,b分别代表什么意义?a. ;b. 。
(2)该反应是 反应(填“吸热”或“放热”),△H (填“< 0”或“> 0”)。
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示: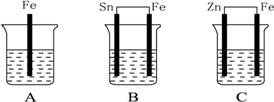
(1)A中反应的离子方程式是。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。
短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿 润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
(1)写出E元素在周期表中的位置
(2)写出A元素气态氢化物的结构式
(3)B的氢化物和E的氢化物反应所得生成物的电子式为 。
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为 。
短周期元素X、Y、Z在周期中位置关系如图所示。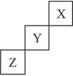
(1)X元素的单质分子式是_____________,若X核内中子数与质子数相等,X单质的摩尔质量是_____________。
(2)Z元素的单质是一种 _____________色的_____________体。该单质与铁粉反应的化学方程式为_____________________________________________________。
_____________色的_____________体。该单质与铁粉反应的化学方程式为_____________________________________________________。
(3)Y元素的单质与H2O反应的化学方程式为____________________________________,若1 mol Y单质反应,转移_____________mol电子。
回答下列问题
(1)画出磷原子的原子结构示意图:。
(2)写出H2S分子的电子式:。
(3)写出表示含有8个质子,10个中子的原子的化学符号: 。
。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a =。
(5)用电子式表示氯化镁的形成过程: 。
。
(6)写出Na2O2中所含化学键的类型。
(7)拆开1mol H—H键,1mol N—H键,1mol 键分别需要吸收的能量为436kJ ,391kJ,946kJ:
键分别需要吸收的能量为436kJ ,391kJ,946kJ:
则1mol N2完全转化成NH3热量(填“吸收”或“放出”)kJ;
(8)利用下列反应:Fe + Cu2+= Fe 2+ + Cu 制一个化学电池,写出电极反应式:
负极:;正极。
[有机化学基础] 有机物A的结构简式为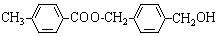 ,从A出发,可发生图示中的一系列反应。其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志。
,从A出发,可发生图示中的一系列反应。其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志。
已知:
④甲醛分子中4个原子共平面。
请回答下列问题:
(1)写出A中含有的官能团的名称________________________
(2)写出下列物质的结构简式:J____________;F__________________。
(3)写出下列反应的化学方程式(注明反应条件并配平)
H→M________________________;D+I→K_____________________。
(4)与B互为同分异构体,属于酯类且含有苯环的化合物有_____种。
(5)C分子中处于同一平面的原子最多可有__________个。