把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+ O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
在氮的单质和化合物中,遇到HCl会产生白烟的是;与氢氧化钙加热发生反应产生刺激性气味气体的是。(用字母填空)
| A.氮气 | B.氨气 | C.硝酸钠 | D.氯化铵 |
食品和药物安全是党和国家高度重视的民生问题。请你根据题意,用下列选项的字母代号填空。
| A.阿司匹林(乙酰水杨酸) | B.青霉素 | C.抗酸药(氢氧化铝) | D.麻黄碱 |
(1)可治疗支气管哮喘,但不宜过多服用的药物是。
(2)治疗胃酸过多,但患有严重的胃溃疡,应该选择。
(3)是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是。
(4)能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是。
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为 。
。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24 L。(设电解前后溶液的体积均为1 L,不考虑水的消耗或气体的溶解)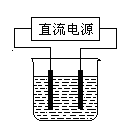
①理论上,电解后溶液中c(OH—)=mol/L。
②若实际测得反应后溶液的c(OH—)=0.1mol/L,则造成这种误差的原因可能是:
a.2H2O 2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是g。
2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是g。
b.还可能为(用离子方程式表示)。
经测定,该实验中溶液实际减少的质量为4.23 g,则所产生的气体及其物质的量之比为。
从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制Cu(OH)2在加热条件下充分反应可生成2mo lCu2O。分析图表回答问题:
lCu2O。分析图表回答问题: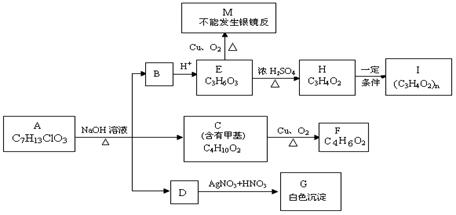
(1)A的结构简式:或
(2)写出反应类型: E→H 、H→I ;
(3)写 出C→F的化学方程式:
出C→F的化学方程式: 。
。
(4)请设计出由丙烯合成E物质的反应流程图(有机物用结构简式表示,必须注明反应条件)。提示:①合成过程中无机试剂任选;②反应流程图表示方法
示例如下:
现有A、B、C、D、E、F六种化合物,它们分别由下列五种原子团中的两种不同的基团组成,这五种基团是-CH3,-C6H5,-OH,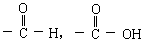 。
。
已知:(1)A是无色晶体,有特殊气味,在空气中易氧化成粉红色;(2)B、C能发生银镜反应,C的相对分子质量大于B;(3)D与少量氢氧化钠溶液反应,得到酸式盐;与过量氢氧化钠溶液反应,生成正盐。D可以和A的钠盐反 应生成A;(4)E可以由B氧化制取;(5)F能氧化成最简单的醛。根据上述条件,请推断ABC
应生成A;(4)E可以由B氧化制取;(5)F能氧化成最简单的醛。根据上述条件,请推断ABC
DEF。在上述具有酸性的化合物中,相同条件下酸性由强到弱的顺序是。(用结构简式表示)