(8分)在相同温度和相同压强状况下,相同体积的CO和CO2中,求以下数据:
(1)它们所含的氧原子数目之比为
(2)它们的质量之比为
(3)它们的密度之比为
(4)它们所含的电子数之比为
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂
中铁元素的含量。实验步骤如下: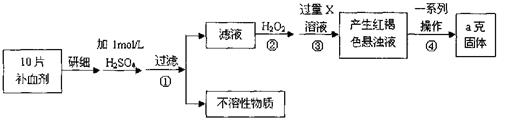
请回答下列问题:
(1)步骤②加入过量H2O2的目的:
(2)步骤③中反应的离子方程式:
(3)步骤④中一系列处理的操作步骤:过滤、、灼烧、、称量。
(4)若实验过程中无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+= 5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
②某同学设计的下列滴定方式中,最合理的是(夹持部分略去)(填字
母序号) 
(6)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用
含FeSO4·7H2O的片剂来补充铁,则正常人每天需服用含mgFeSO4·7H2O的
片剂。
A、D、E、X、Y五种短周期元素,它们的原子序数依次增大,A元素的原子
是半径最小的原子,D元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐;X与A同主族;Y元素的最外层电子数是其次外层电子数的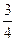 倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
倍;A、D、X、Y四种元素,每一种均能与E元素形成原子个数比不相同的若干化合物。
(1)画出Y元素离子的结构示意图;写出常温下Y的氢化物与其最高价氧化物对应水化物的浓溶液反应的化学方程式。
(2)由A、D、E、Y四种元素形成的强酸的酸式盐的名称为,该盐的水溶液中各离子浓度由大到小的顺序为。
(3)科学家用D、E、X 三种元素形成的化合物XDE3和X2E,在573K时反应制得了离子化合物X3DE4;经测定X3DE4中各原子的最外层电子都达到了8电子稳定结构,则DE43-的电子式为,X3DE4与水能剧烈反应转化为常见物质,写出反应的化学方程式:。
现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠
④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)_。
(2)④⑤⑥⑦⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___ ___。 (3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 _____。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 _____。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=。
(5)25℃时,有pH=x的盐酸和pH="y" 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=____(填数据);②若x+y=13,则a/b=____
(填数据);
③若x+y>14,则a/b=____(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH x和y的关系式(填表达式)。
实验室用下列方法测定某水样中O2的含量。
(1)用如图所示装置,使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2的反应的离子方程式为______________________________________。
实验步骤:
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是______________________________________。
②用注射器抽取20.00 mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是_______________。c是长橡胶管,使用较长橡胶管的目的是__________________________________。
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。
⑧用0.005 mol·L-1的Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如图所示。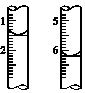
⑨经计算,此水样中氧(O2)的含量为________mg·L-1。
t ℃时,将2 mol气体A和1 mol气体B充入容积为2 L的恒容密闭容器中,发生如下反应:2A(g)+B(g)xC(g),2 min时反应达到平衡状态(温度仍为t ℃),此时B还有0.6 mol,并测得C的浓度为0.6 mol·L-1。请回答下列问题:
(1)判断该反应达到平衡状态的标志是________(填字母)。
a.B和C的物质的量浓度之比为1∶x
b.容器中的压强保持不变
c.A的百分含量保持不变
d.A的生成速率与B的消耗速率之比为2∶1
e.容器内混合气体的密度保持不变
(2)x=____________;从反应开始到平衡时反应速率v(A)=__________________。
(3)若保持温度不变,增大容器体积,则反应速率________(填“增大”、“减小”或“不变”)。
(4)若向平衡混合物中再充入a mol C,t ℃再次达到平衡时B的物质的量为__________ mol。