水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+ MnO4—+ = Mn2++ CO2↑+
该步骤中KMnO4溶液紫色会逐渐褪去.某探究小组测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.
请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请写出滴定前的液面读数 。
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时 。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) 。
资料卡片:
1、有机物可被HNO3氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
(14分)已知A是一种含两种元素组成的液态有机溶剂,N带有磁性,B、F、L、O、P是中学化学常见单质, B、D、F、J都含有一种相同的元素且它们的相对分子质量关系是M(D)=2M(B)=2M(F),A和B反应前后气体体积(常温常压)保持不变,I是一种常用的氮肥,反应①②③均是化工生产中的重要反应。
⑴A的化学式___________。
⑵写出反应①的化学方程式_______________________________。
在工业上叫______________
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式___________________
(4)写出在加热条件下单质F与单质L的化学反应方程式___________________________。
(5)请设计一个实验方案,完成反应④,并在答题卡指定位置绘出实验装置图。
实验室制取乙烯时,常因温度过高而发生副反应。完成下列问题:
(1)写出实验室制取乙烯的化学方程式:______________________。
(2)较高温度下,乙醇与浓H2SO4反应生成了CO2、SO2、H2O,写出并配平此副反应:________________,反应过程中,混合液颜色加深,变黄、变黑,证明___________________。
(3)请用下图中编号为①②③④的装置设计一个实验,以验证乙烯的性质和上述混合气体中含有CO2、SO2和水蒸气。用装置的编号表示装置的连接顺序(按产物气流从左到右):________→________→________→________。
(4)装置①中A瓶的现象是___________________,原因是______________________;B瓶的作用是______________________;确证乙烯存在的现象是______________________。
(5)装置③中加的固体药品是________,以验证混合气体中含有________;装置②中盛的溶液是________,以验证混合气体中的________。
(6)装置①在整套装置中所放位置的理由是_________________________________________。
(1) 实验过程中,可能观察到的主要现象有:
① ;
② ;
③ ;
④ ;
(2) 用该装置做铜与浓硝酸反应的实验,最突出的优点是 。
(3) 若要验证最终得到的气体生成物,最简便的方法是 。
某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计如下实验方案,请回答有关问题:
(1)称取样品a g,称量时应该使用的仪器名称是_________。
(2)将样品溶于足量的稀盐酸,过滤,溶液中主要含有________,滤渣中含有_______。
(3)滤液中加入过量的NaOH溶液,过滤。所得滤渣的化学式为_________。
(4)往步骤(3)的滤液中通入足量的CO2气体,过滤。反应的离子方程式为_________。
(5)步骤(4)过滤所得的滤渣用蒸馏水洗涤3次,烘干后高温灼烧至质量不再减轻为止,称得其质量为b g,则原样品中铝的质量分数为_________(用a、b表示)。
铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法: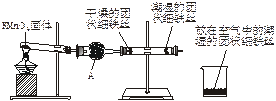
图11-21
首先检查制氧装置的气密性,然后按图11-21连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于_________。能表示其原理的反应方程式为___________________________。
(2)仪器A的名称为_________,其中装的药品可以是_________,其作用是_________。
(3)由实验可知,该类铁生锈的条件为_________。决定铁生锈快慢的一个重要因素是_________。