为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。不正确的操作顺序是
| A.①④②⑤③ | B.⑤④②①③ | C.②⑤④①③ | D.⑤②④①③ |
把浓度均为0.1mol/L的NaOH溶液、H2SO4溶液和氨水等体积混合,所得混合液中各种离子浓度的大小顺序正确的是
A.[SO42-]>[Na+]>[NH4+]>[OH-] >[H+] >[H+] |
B.[Na+]>[NH4+]>[SO42-]>[H+]>[OH-] |
| C.[SO42-]=[Na+]>[NH4+]>[H+]>[OH-] | D.[SO42-]=[Na+]>[H+]>[NH4+]>[OH-] |
下图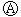 为直流电源,
为直流电源,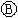 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,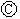 为电镀槽,
为电镀槽,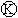 为开关(处于断开状态),接通电路后发现
为开关(处于断开状态),接通电路后发现 上的c点显红色.为实现铁上镀锌,再接通
上的c点显红色.为实现铁上镀锌,再接通 ,整个过程下列叙述正确的是
,整个过程下列叙述正确的是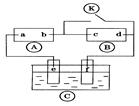
A.a为 直流电源的负极 直流电源的负极 |
| B.c极发生的反应为2H++2e-=H2↑ |
| C.f电极为锌板 |
| D.e极发生还原反应 |
把Ca(OH)2固体放入一定量的蒸馏水中,有 Ca(OH)2(s) Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
| A.溶液中Ca2+数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
下列叙述正确的是
| A.保护地下钢管不受腐蚀,可使它与直流电源负极相连 |
| B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阴极 |
| D.电解稀硫酸制氢气、氧气时可用铜作阳极 |
NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下,11.2升的戊烷所含的分子数为0.5NA |
| B.28g乙烯所含共用电子对数为4NA |
| C.标准状况下,11.2升二氯甲烷所含分子数为0.5NA |
| D.现有C2H4、C3H6、C4H8的混合气体共14g,其原子数为3NA |