(共12分)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-的电子式可表示为 ;1mol C22-中含有的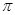 键数目为 。
键数目为 。
(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为 。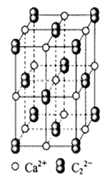
Ⅰ、现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3 ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-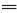 H2O,该反应的化学方程式为 。
H2O,该反应的化学方程式为 。
(2)⑩在水中的电离方程式为 ,
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水。医生常用胃舒平(主要成分氢氧化铝)来治疗,它与胃酸反应的离子方程式: 。
(4)上述十种物质中属于电解质的是: 。(填序号)
Ⅱ、阅读、分析下列两个材料: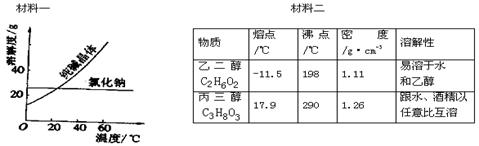
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项):
| A.蒸馏法 | B.萃取法 | C.“溶解、结晶、过滤”的方法 | D.分液法 |
①分离汽油和水的最佳方法是 ;
②去除纯碱中的少量氯化钠杂质,最好应用 ;
③将乙二醇和丙三醇(乙二醇和丙三醇互溶)相互分离的最佳方法是 。
(1)相同物质的量的O2和CO分子个数比为________,所含氧原子的个数比为________,常温常压下下体积比:________。
(2)实验室要用Na2CO3配制500 mL 0.1 mol·L-1 Na2CO3溶液,回答下列问题:
①应该用托盘天平称取Na2CO3________g。
②需要的仪器:_____ ___,____ ____,___ ___,__ ,____ _____。
③若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.转移液体时部分溅出 __________________;
B.定容时加水超过刻度线__________________;
C.最终定容时俯视观察液面 。
有一包白色粉末,可能含有NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的至少两种。现进行如下实验。
①取少量白色粉末,加入足量蒸馏水,得到无色溶液;
②取少量上述溶液,加入NaOH 溶液,无明显现象。
(1)根据实验现象判断,该白色粉末中一定不含 ,剩余成分的可能组合有 种;
(2)利用①中所得溶液设计实验,证明该粉末由NaCl、Na2SO4、Na2CO3组成。请填写下表空白。
钙元素是人体必须的常量元素,所有细胞都需要钙元素。正常人体血液中钙离子浓度为2.2x10-3mol/L~2.71x10-3mol/L.。请回答下列问题。
(1)血液中钙离子浓度高于或等于2.75x10-3mol/L 称为高血钙症。一个成年人全身血液总量约为4L,则高血钙病人血液中的钙离子至少为 mol;
(2)如果以“g/L”表示,正常人体血液中钙离子浓度的最小值为 g/L;
(3)草酸钙(CaC2O4)难溶于水,是人体内结石的主要成分,其摩尔质量为 g/mol;豆腐中含有较多钙盐(如硫酸钙),硫酸钙的电离方程式是 ;菠菜、洋葱中含有丰富的草酸钠(Na2C2O4),硫酸钙与草酸钠反应的化学方程式是 ,由此说明生活中上述食物正确的食用方法是 。
重铬酸钠(Na2Cr2O7)广泛用于印染、制革、医药、电镀等。以下是与重铬酸钠有关的系列转化关系。
(1)Na2Cr2O7中Cr 的化合价是
(2)上述④ 、⑤、⑥ 转化过程中,属于非氧化还原反应的是
(3)CrCl3可溶于水,它与NaOH 溶液反应生成灰蓝色、难溶于水的Cr(OH)3,请写出该反应的离子反应方程式
(4)过程①的化学方程式为Na2Cr2O7+14HCl(浓)=2CrCl3+2NaCl+3Cl2↑+7X,其中X 的化学式是 ,氧化剂是 , 被氧化的元素是 ,反应过程中每生成1mol Cl2,转移电子 mol。