已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为 。电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子反应方程式: 。残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为 mol·L—1,Fe2+的浓度为 mol·L—1
下图为周期表中的一部分。已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1 .5倍。
(1)B元素符号是: _______、D在元素周期表中第_______族。
(2)四种元素中原子半径最大的是(填元素符号)_______,B、C、D三种离子中半径最大的是(填离子符号)_______。
(3)B比C的氢化物的沸点高是因为_______;A、D两元素的气态氢化物相互反应的生成物的电子式:,其中存在_______键、_______(填“极性”或“非极性”)共价键。
(4)写一个离子方程式证明C和D的非金属性相对强弱:。
在水溶液中有质子数相同,电子数也相同的A、B、C三种离子。A、B都能与阴离子D反应,D的电子总数与A相等,但质子总数比A少2个。A与D反应生成分子中电子总数与A相等,但质子总数比A少1的气体E。B与D反应时生成的分子中电子总数、质子总数与E都相等的液体F。则A~F的化学式或符号分别为:
A______;B________;C________;D________;E________;F________。
试回答下列各问题:
(1)如图Ⅰ所示是1 mol NO2和CO反应生成 CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:。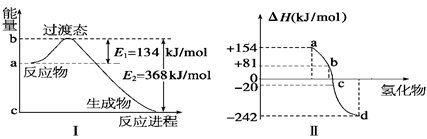
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)="==" 2HCl(g) ΔH="-185" kJ/mol;
键能ΔH298(H—H)="436" kJ/mol,ΔH298(Cl—Cl)="247" kJ/mol,则ΔH298(H—Cl)=。
②图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲生成氢化物时的焓变数据,根据这组焓变数据可确定a、b、c、d分别代表的元素,试写出硒化氢发生分解反应的热化学方程式:。
(3)已知: ①Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)ΔH="-a" kJ/mol
2Fe(s)+3CO2(g)ΔH="-a" kJ/mol
②3Fe2O3(s)+CO(g)  2Fe3O4(s)+CO2(g)ΔH="-b" kJ/mol
2Fe3O4(s)+CO2(g)ΔH="-b" kJ/mol
③Fe3O4(s)+CO(g)  3FeO(s)+CO2(g)ΔH="+ckJ/mol"
3FeO(s)+CO2(g)ΔH="+ckJ/mol"
则FeO(s) +CO(g)  Fe(s)+CO2(g)ΔH=-。
Fe(s)+CO2(g)ΔH=-。
已知:
① N2 (g) + 2O2 (g) = 2NO2 (g)△H1 =" +" 67.7kJ/mol
②N2H4 (g) +O2 (g) = N2(g) +2H2O (g)△H2 = -534kJ/mol
③1/2H2 (g) + 1/2F2 (g) = HF (g)△H3 = -269kJ/mol
④H2 (g) + 1/2O2 (g) = H2O (g)△H4 = -242kJ/mol
⑤H2O(l)====H2O(g) △H5=+44kJ·mol-1
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出液态肼和足量H2O2反应的热化学方程式_______________________________。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(3)16 g气态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(4根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式____________________________________。
(5)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如: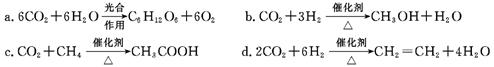
以上反应中,原子利用率最高的是。
(3)若有4.4g CO2与足量H2恰好完全反应,生成液态甲醇和气态水,可放出4.9 kJ的热量,试写出该反应的热化学方程式_______________________________________。
(4)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器,充人1mol CO2和3molH2,进行反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡v(H2)= _____________;该温度下的平衡常数数值=__________。
(5)CO2在自然界循环时可与CaCO3反应。CaCO3是一种难溶物质,其Ksp="=" 2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将4×10-4mol/L Na2CO3溶液与某浓度的CaCl2溶液等体积混合,则生成沉淀所需CaCl2溶液的最小浓度为______________。