Ⅰ.在一定条件下,xA+yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向______移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为______。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。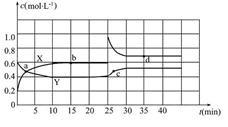
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是__________。下列不能说明该反应已达到平衡状态的是___________。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子质量不随时间变化而改变
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
② 0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数K1=_______。
N2O4(g)的平衡常数K1=_______。
③ 25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数K2_____K1(填“>”、“=”或“<”)。
N2O4(g)的平衡常数K2_____K1(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是______________ (用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.升高温度
C.缩小容器体积 D.加入一定量的N2O4
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_________________________________。
(2)在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:______________________________。
下列溶液中可能含有SO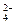 、SO
、SO 、S2-、Cl-、Br-、I-、NO
、S2-、Cl-、Br-、I-、NO 、Na+、Mg2+等离子.
、Na+、Mg2+等离子.
(1)滴入溴水后,溶液由无色变为棕黄色,并出现浑浊,则溶液中一定含有_______。
(2)若加氯化钡溶液及盐酸的混合溶液无沉淀生成.若先加入氯水,然后再加入氯化钡溶液和盐酸,有白色沉淀生成,则原溶液中一定含有_____________________。
(3)若加入氢氧化钡溶液无沉淀生成,加入硝酸银溶液也无沉淀生成,则原溶液中阴、阳离子只可能是_____________________________。
在酸性条件下,许多氧化剂可使KI溶液中的I-氧化,
例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式
;
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)=:::.
已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)写出该反应的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为。
(3)阿伏加德罗数常数为(用含a、b的代数式表示)。
(1)用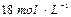 的硫酸配制
的硫酸配制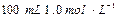 硫酸,若实验仪器有:
硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
G.50mL烧杯 H.100mL容量瓶
实验时应选用仪器的先后顺序是(填入编号)_________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次