(8分)工业生产硝酸铵的流程图如下:请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_____________________________(任写一条)。
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量___________(填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式:___________________________________________________。
有一种线性高分子,结构如下图所示。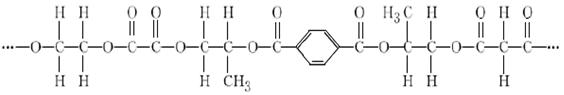
完成下列填空:
(1)该高分子由______种单体(聚合成高分子的简单小分子)聚合而成。这些单体含有的官
能团名称是___________________。
(2)写出上述单体中式量最小和式量最大的分子间发生缩聚反应的化学方程式
__________________________________________________。
(3)上述单体中式量最小的分子在一定条件下完全消去后所得物质的结构简式为
。该物质加聚生成的高分子(填“能”或“不能”)________与溴的CCl4溶液
发生加成反应。该物质三分子聚合成环,所得物质的名称是_______。
(4)上述单体中其中互为同系物的是(写出所有可能,用结构简式表述)
________________________、________________________________________。
工业上高纯硅可以通过下列反应制取:SiCl4(g)+ 2H2(g)  Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为0.1mol/(L·min),3min后达到平衡,此时获得固体的质量g。
(2)该反应的平衡常数表达式K=。可以通过_______使K增大。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是。
a.2v逆(SiCl4)=v正(H2)
b.断开4molSi-Cl键的同时,生成4molH-Cl键
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是______,第3分钟改变的条件是__________,各平衡态中氢气转化率最小的时间段是_____________ 。
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。完成下列填空:
(1)该反应中氧化剂是_________,氧化产物是_________。
(2)写出该反应的化学方程式____________________________________________。
(3)每消耗24.0g碳时,有mol电子发生转移,生成P4_______g。
(4)反应所得混合气体,折算成标况下,其气体密度为g/L。
现有1——20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:
| 元素 |
物质性质或微粒结构 |
| A |
M层上有2对成对电子 |
| B |
B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂 |
| C |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| D |
元素最高正价是+7价 |
(1)元素A的原子最外层共有______种不同运动状态的电子,有___种能量不同的电子。B的
离子与D的离子相互组合形成的干燥剂的化学式是_________。
(2)元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式(用元素符号表示)
_________________
(3)元素A与元素D相比,非金属性较强的是_____(用元素符号表示),下列表述中能证明
这一事实的是_______
A.常温下A的单质和D的单质状态不同
B.A的氢化物比D的氢化物稳定
C.一定条件下D能从A的氢化物水溶液中置换出A单质
D.HD的酸性比HA酸性强
(4)C的氢化物固态时属于______晶体,该氢化物与A的最高价氧化物水化物反应的化学方程式是__________________________________________________。
5—氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:
已知: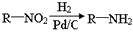
(1)5—氨基酮戊酸盐中非含氧官能团的名称是。
(2)C→D的反应类型为。
(3)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一种环境的氢原子,则A的结构简式为。
(4)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式。
(5)写出D→E反应的化学方程式。
(6)已知,请结合题中所给信息,写出由CH3CH2COOH、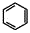 为原料合成
为原料合成 单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选)。
单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选)。
①第一步的合成路线:
②最后一步的化学方程式: