高一学生小强的化学笔记中有如下内容:
①纯净物按照组成可以分为单质和化合物
②单质又可分为金属和非金属
③无机化合物主要包括:酸、碱、盐和氧化物
④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体
⑤水溶液能导电的化合物就是电解质
⑥按照树状分类法可将化学反应分为:氧化还原反应和离子反应
⑦氧化还原反应的特征是化合价升降
你认为他的笔记中有几处错误
| A.三处 | B.四处 | C.五处 | D.六处 |
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
| Y |
Y2是空气中含量最高的气体单质 |
| Z |
Z的基态原子最外层电子排布式为2s22p4 |
| W |
W的一种核素质量数为27,中子数为14 |
(1)W位于元素周期表第周期第族;Z和W的最简单的离子半径大小关系为
(用离子符号表示)
(2)一种X形成的单质,是自然界硬度最大的物质,若熔化这种单质,所需克服的微粒间的作用力是;Y的电负性比Z(填“大”或“小”)
(3)W的单质与NaOH溶液反应的离子方程式为, W在高温条件下可还原高熔点的金属氧化物制的金属单质,写出W还原Cr2O3反应的化学方程式:。
(4)煤燃烧产生的烟气中有Y的氧化物,会引起严重的环境问题,因此,常用XH4催化还原以消除污染,已知:
XH4(g)+2 YO2(g)="=" Y2(g)+ XO2(g)+2H2O (g) △H1= -867kJ/mol
2 YO2(g) Y2O4(g)△H2=-56.9kJ/mol
Y2O4(g)△H2=-56.9kJ/mol
某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示,下列有关说法不正确的是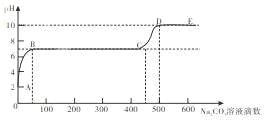
| A.开始时溶液pH=2是因为残留液中还有盐酸剩余 |
| B.AB段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 |
| C.BC段发生的反应为:Ca2++CO32-= CaCO3↓ |
| D.滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) |
工厂排放的SO2烟气对环境造成污染,某企业用下列流程综合处理,下列有关说法正确的是
| A.二氧化硫吸收塔中发生的反应为:SO2+SO32-+H2O=2HSO3- |
| B.氨气吸收塔中发生的反应为:HSO3-+OH-= H2O+SO32- |
| C.上述流程利用的是氧化还原反应原理 |
| D.上述流程可降低碳排放,符合低碳经济 |
美国科学家找到了一种突破目前锂离子电池充电量和充电速度限制的方法,该方法将硅簇置入石墨烯层之间,达到提升电池内部锂离子密度的效果,这种材料制成的新型锂电池充电容量和效率都比普通锂电池提高近十倍,下列有关说法正确的是
| A.电池工作时,锂电极为阳极,发生还原反应 |
| B.电池充电时,Li+向阴极移动 |
| C.该电池的化学能可完全转化为电能 |
| D.新材料就是碳和硅化合而成的碳化硅材料 |
催化反硝化法可治理水中硝酸盐的污染,该方法是用H2将NO3-还原为N2,反应的化学方程式为:5H2+ 2 NO3- xOH-+ N2+4H2O。下列有关说法正确的是
xOH-+ N2+4H2O。下列有关说法正确的是
| A.该反应为置换反应 |
| B.每生成1mol N2,反应转移5mole- |
| C.x=2 |
| D.反应过程中溶液pH减小 |