下列有关反应限度的叙述正确的是
| A.大多数化学反应在一定条件下都有一定的限度 |
| B.依据焓判据:NH4HCO3受热分解可自发进行 |
| C.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 |
| D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深 |
下列中的诗句内容基本不涉及化学变化的是
| A.王安石的《元日》 :“爆竹声中一岁除,春风送暖入屠苏” |
| B.刘禹锡的《浪淘沙》 :“美人首饰侯王印,尽是江中浪底来” |
| C.刘琨的《重赠卢谌》 :“ 何意百炼钢,化为绕指柔” |
| D.李商隐的《无题》 :“春蚕到死丝方尽,蜡炬成灰泪始干” |
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是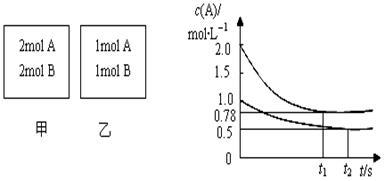
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
nY(g),ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
 容器体积 容器体积温度 |
1 |
2 |
4 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20[ |
0.90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
A.m>n
B.温度不变,压强增大,Y的质量分数减少
C.Q<0
D.体积不变,温度升高,平衡向逆反应方向移动
HM和HR的溶液分别加水稀释时pH变化如下图。下列叙述中正确的是
| A.HR可能是弱酸 |
| B.x点时c(R-)=c(M-) |
| C.HM是一种强酸 |
| D.稀释前,c(HR)=10c(HM) |
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂。下列说法中正确的是
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,若容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g) B(g)+2C(g)ΔH=-50a kJ·mol-1
B(g)+2C(g)ΔH=-50a kJ·mol-1