下列变化过程,需要加入氧化剂的是
| A.HCl→MgCl2 | B.Na+→Na | C.CO→CO2 | D.Fe3+→Fe2+ |
欲使2,3-二溴丁烷发生消去反应生成2-丁烯,应选择的反应试剂和条件是
| A.浓H2SO4加热 | B.NaOH的醇溶液加热 |
| C.NaOH的水溶液常温 | D.金属锌粉加热 |
在一定条件下CH2=CHCH3不能发生的反应类型有
| A.取代反应 | B.加成反应 | C.消去反应 | D.聚合反应 |
下列有机物与HBr或HCN都能发生加成反应的是
| A.CH2=CHCH3 | B.CH≡CH | C.CH3CHO | D.CH3C≡N |
能在一定条件下发生加聚反应生成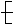 CH2—CH==C(CH3) CH2
CH2—CH==C(CH3) CH2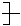 的单体的是
的单体的是
| A.丙烯 | B.乙烯和丙烯 |
| C.2-甲基-2-丁烯 | D.2-甲基-1,3-丁二烯 |
下列物质中不能发生消去反应的有
| A.CH3Br | B.(CH3)3C—Br |
| C.(CH3)3C—CH3Cl | D.CH3CH(Br)CH2Cl |