分析下图所示的四个装置,其中结论正确的是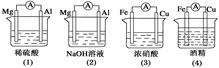
| A.(1)(2)中Mg作负极 |
| B.(3)中Fe作负极,电极反应为Fe-2e-===Fe2+ |
| C.(2)中Mg作正极,电极反应为6H2O+6e-===6OH-+3H2↑ |
| D.(4)中Fe作负极,电极反应为Fe-2e-===Fe2+ |
有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB====A++HB-,HB- H++B2-
H++B2-
其中错误选项的组合是( )
| A.①② | B.③④ | C.②③ | D.①④ |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是( )
| A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
常温下,浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;③CH3COONa溶液。下列说法不正确的是( )
| A.溶液的pH:②>③>① |
| B.水电离出的c(OH-):③>①>② |
| C.②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)="0.1" mol/L |
常温下,向0.1 mol/L的H2SO4溶液中逐滴加入0.1 mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是
( )
| A.a~d溶液的pH:a<b<c<d |
| B.a~d溶液的导电能力:a<b<c<d |
| C.b处溶液的c(H+)与d处溶液的c (OH-)相等 |
| D.c处溶液和d处溶液均呈碱性 |
常温下,将NaHY晶体加入水中溶解,得到0.1 mol/L NaHY溶液,下列叙述正确的是( )
| A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y) |
| B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-) |
| C.若溶液中粒子浓度关系为c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性 |
| D.将NaHY晶体加入水中一定能促进水的电离 |