(本题共10分)
在 1.0L恒容密闭容器中放入0.10 mol A (g),在一定温度进行如下反应。
A(g)  2B(g) + C(g) + D(s) △H =+85.1 kJ / mol
2B(g) + C(g) + D(s) △H =+85.1 kJ / mol
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。
| 时间t/min |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
| P/P0 |
1.00 |
1.50 |
1.80 |
2.20 |
2.30 |
2.38 |
2.40 |
2.40 |
回答下列问题:
(1)该反应的平衡常数表达式K= 。
(2)0~2 min内的平均反应速率v(B)= 。
(3)下列能提高 A 的转化率的是 。
A.升高温度 B.向体系中通入A气体
C.减少D的物质的量 D.向体系中通入稀有气体He
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 D 的取值范围n (D) mol 。
(5)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时 B 的浓度为 。(保留三位有效数字)。
在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加l对共用电子。试回答下列问题:
①分子式为CnH2n+2的烷烃中碳碳原子间共用电予对数为
②分子式为CnH2n-6的链烃分子中碳碳原子问共用电子对数为
③CX可看作作烃减氢后的产物,若某物质分子中碳碳原子间共用电子对数为14 0,则符合该条件的碳单质的化学式为;符合该条件的稀烃的分子式是。
0,则符合该条件的碳单质的化学式为;符合该条件的稀烃的分子式是。
下列是中学化学实验操作的内容:①碘的升华;②氢氧化钠溶解于水;③过氧化钠溶解于水;④氯化氢溶解于水。其中没有发生化学键断裂的是______________ ; 只发生离子键断裂的是____________ ; 只发生共价键断裂的是______________ ; 既发生离子键断裂, 又发生共价键断裂的是____________ .
(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3 ②12C和14C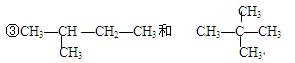
互为同位素的是,互为同素异形体的是__________,互为同分异构体的是_____________
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题: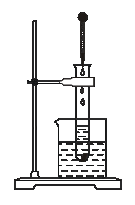
①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1 个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,D+具有与Ne原子相同的电子层结构。
个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,D+具有与Ne原子相同的电子层结构。
(1)试判断A、B、C、D四种元素的名称。
A__________,B______________, C___________,D。
(2)由A、B、D三种元素 组成的化合物的电子式为
组成的化合物的电子式为 ,
,
其所包含的具体化学键型为。
(3)用电子式表示A2B的形成过程。
(4)如上图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到气球膨胀的现象,请用离子方程式解释其原因:
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子分子,原子间存在3对共用电子对 |
| X |
M层有3个电子 |
| Y |
最外层电子数是最内层电子数2倍,其最高价氧化物是一种固体,用于生产光导纤维 |
| Z |
最低负价为—2价,且无最高正价 |
用化学符号回答以下问题:
(1)比较:氢化物的稳定性:TZ,最高价氧化物对应水化物的酸性: TY。(填“>”、“<”或“=”)
TY。(填“>”、“<”或“=”)
(2)写出T的氢化物的电子式:。
(3) X的最高价氧化物对应水化物与烧碱反应的离子方程式为:
(4) T、X、Y、Z四种原子的半径由大到小的顺序为:。