(10分)现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液
⑥铜 ⑦熔融的KOH ⑧蔗糖,
其中属于电解质的是 ,属于非电解质的是
(1)写出FeCl3的电离方程式:__________________________________________,
(2)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:________________________,
(3)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入 溶液,继续煮沸至 ,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做 。
③区分胶体和溶液常用的方法叫做 。
【化学——选修化学与技术】现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下: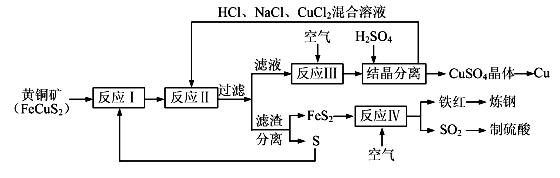
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 _____________________ ________、___________________________________。
(2)反应Ⅰ的产物为(填化学式) ___________________ 。
(3)反应Ⅲ的离子方程式为 ____________________________________________________。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 ___________
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2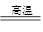 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
| A.反应中被还原的元素只有氧 | B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 | D.当有8mol铜生成时,转移电子数目为100NA |
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为________________________________________________ 。
草酸作为一种重要的化工原料,某学习小组的同学拟以甘蔗渣为原料用水解一氧化一水解技术制取草酸。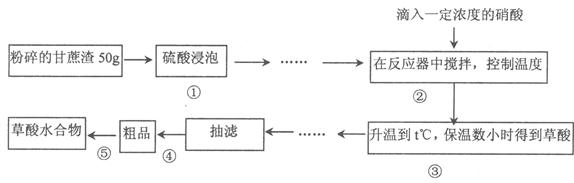
Ⅰ、步骤④是减压抽滤(见下图),其优点是:__________________________________________,当抽滤完毕或中途停止抽滤时,为了防止自来水倒吸入B装置,最佳的操作是___________。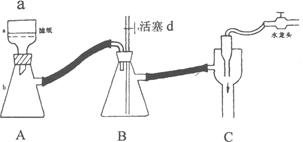
Ⅱ、该小组同学为了确定产品H2C2O4·xH2O中的的x值,进行下列实验:
①取w g产品配成100mL水溶液;
②量取25.00mL草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1KMnO4溶液滴定。 请回答下列问题:
(1)实验①中,需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和___________。
(2)写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:_____________________________。
(3)若滴定时,前后两次读数分别为a mL和b mL,由此计算出该草酸晶体的x值是__________
Ⅲ、该小组同学在做实验Ⅱ②时发现向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快,即反应速率由小变大。为此,他们设计了实验进行探究:
【实验用品】 仪器:试管(若干个并编号①,②,③…)、胶头滴管(若干支)、秒表
试剂:0.1 mol/L H2C2O4溶液、0.1 mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
实验(1):在①号和②号试管中分别先加入5m1 0.1mol/L H2C2O4溶液,然后各加10滴稀硫酸,且在②号试管中加入少量硫酸锰固体。再在两支试管中各加入5滴0.1mol/LKMnO4溶液。现象如下(表1)
| 编号 |
①号试管 |
②号试管 |
| 褪色时间 |
90s |
5 s |
| 实验现象 |
均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(2):在①号和②号试管中分别加入5m1 0.1mol/L H2C2O4溶液,在②号试管中再滴加l0滴稀硫酸,然后在两支试管中各加入5滴0.1 mol/L 的高锰酸钾溶液。现象如下(表2)
| 编号 |
①号试管 |
②号试管 |
| 褪色时间 |
100 s |
90 s |
| 实验现象 |
均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):在①号、②号和③号试管中分别加入5m1 0.1mol/L H2C2O4溶液,然后在①、②、③号试管中依次加入10滴、l mL、2 mL稀硫酸溶液,然后各加入5滴0.1 mol/L的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象如下(表3)。
| 编号 |
①号试管 |
②号试管 |
③号试管 |
| 褪色时间 |
88 s |
100 s |
120 s |
| 实验现象 |
均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1)设计实验(1)对应的假设是_________________________________________________。
实验(1)得出的结论是____________________________________________________。
(2)由实验(2)和实验(3)得出的结论是_________________________________________m___。
已知A是一种含两种元素组成的液态有机溶剂,N带有磁性,B、F、L、O、P是中学化学常见单质, D、F、J都含有一种相同的元素且它们的相对分子质量关系是M(D)=2M(B)=2M(F),A和B反应前后气体体积(常温常压)保持不变,I是一种常用的氮肥,反应①②③均是化工生产中的重要反应。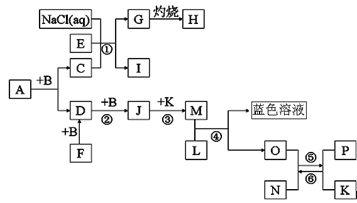
⑴A的化学式___________。
⑵写出反应①的化学方程式_______________________________。在工业上叫______________
⑶高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式______________________________
(4)写出在加热条件下单质F与单质L的化学反应方程式__________________________________。
(5)请设计一个实验方案,完成反应④,请在下面方框内绘出实验装置图。
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
C(s)+O2(g) =CO2(g);△H=" -393.5" kJ/mol
2C(s)+O2(g)=2CO(g);△H= -221kJ/mol
则2NO(g)+2CO(g) N2(g) +2CO2(g)的△H=___________。
N2(g) +2CO2(g)的△H=___________。
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,且N2占平衡总体积的1/4。
①则该反应的平衡常数K=___________。(用只含a、V的式子表示)
②判断该反应达到平衡的标志是_________
A.v生成(CO2)=v消耗(CO)B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是___________
A.降低温度B.增大压强同时加催化剂
C.升高温度同时充入N2D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。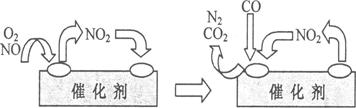
①写出此变化中的总化学反应方程式:________________________________________。
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。请你判断是否可行并说出理由:_____________________________________________________________。
在一个容积固定为2 L的密闭容器中,发生反应aA(g)+bB(g)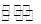 pC(g)
pC(g)
ΔH=?反应情况记录如下表:
| 时间 |
c(A)/mol·L-1 |
c(B)/mol·L-1 |
c(C)/mol·L-1 |
| 0 min |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请仔细分析表中数据,回答下列问题:
(1)a=________,b=_________,p=__________。(取最小正整数)
(2)第2 min到第4 min内A的平均反应速率v(A)="_______" mol·L-1·min-1。
(3)由表中数据可知反应在第4 min到第6 min时处于平衡状态,若在第2 min、第6 min、第8 min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2 min__________或___________
②第6 min_____________;
③第8 min_____________。
(4)若从开始到第4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=________________。