下列反应既属于氧化还原反应,又属于吸热反应的是
| A.铝片和稀盐酸反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与二氧化碳的反应 | D.甲烷在氧气中的燃烧 |
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是 ( )
| A.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6| |
| B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0 |
| C.A→F,ΔH=ΔH6 |
| D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6| |
已知:①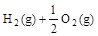 =H2O(g) △H1=a kJ
=H2O(g) △H1=a kJ , ②
, ② =2H2O(g)△H2=b kJ
=2H2O(g)△H2=b kJ ,
,
③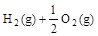 =H2O(l) △H3=c kJ
=H2O(l) △H3=c kJ , ④
, ④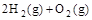 =2H2O(l)
=2H2O(l)
△H4=d kJ 。下列关系式中正确的是()
。下列关系式中正确的是()
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
已知:H2(g)+F2(g)=2HF(g)△H=—270kJ/mol,下列说法正确的是( )
| A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量 |
| B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ |
| C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量 |
已知胆矾溶于水时,溶液温度降低。在室温下将1mol无水硫酸铜制成溶液时,放出热量为Q1kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);
△H=+Q2kJ/mol,则Q1与Q2的关系是
| A.Q1>Q2 | B.Q1<Q2 | C.Q1=Q2 | D.无法确定 |