在1L容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g) 2NH3(g)ΔH ="-92.4" kJ•mol-1,下列关于该反应的说法正确的是
2NH3(g)ΔH ="-92.4" kJ•mol-1,下列关于该反应的说法正确的是
| A.反应达到平衡时共放出46.2 kJ的热量 |
| B.若将容器体积压缩至0.5L,可提高单位体积内活化分子百分数,从而加快正反应速率,降低逆反应速率 |
| C.任何时刻均有:υ(N2)=3υ(H2)=2υ(NH3) |
| D.若保持容器体积不变,继续通入0.5mol N2和1.5mol H2,则N2的转化率变大 |
某同学在研究前18号元素时发现,可以将它们排成如右图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是()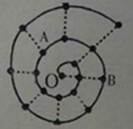
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素
D.A、B两种元素组成的化合物中可能含有共价键
下列离子方程式书写正确的是()
| A.碳酸钙与醋酸反应:CaCO3+2H+====Ca2+H2O+CO2↑ |
| B.碳酸氢钠溶液中加过量氨水:2HCO-3+Ca2++2OH-====CaCO3↓+CO2-3+2H2O |
| C.硝酸铝溶液中加过量氨水:Al3++3NH3·H2O====Al(OH)3↓+3NH+4 |
| D.向次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO |
.短周期元素X、Y、Z、M、R在周期表中的相对位置如下图所示。下列说法中不正确的是()
| A.元素X和Y可以形成两种以上的气态化合物 |
| B.原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C.元素的最高价氧化物对应水化物的酸性R强于M |
| D.加热蒸干由元素B和Z形成的化合物的水溶液可以得到该化合物的晶体 |
将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应: 2A(g)+B(g) 2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol·L-1,下列说法中正确的是()
2A(g)+B(g) 2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol·L-1,下列说法中正确的是()
| A.当容器内混合气体的密度不再发生变化时,反应即达到平衡状态 |
| B.达平衡后若升高温度,该反应的平衡常数将增大 |
| C.平衡时反应物B的转化率为15.0% |
| D.达平衡后,如果此时移走2molA和1molB,在相同温度下再达平衡时C的浓度<0.3mol·L-1 |
.下列实验设计不能达到预期目的是()
| 选项 |
实验操作 |
实验目的 |
| A |
向盛有1ml硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种更难溶的沉淀 |
| B |
在两支试管中分别加入相同体积相同浓度的H2O2溶液,再向其中一支试管中加入适量FeCl3溶液 |
研究催化剂对反应速率影响的 |
| C |
向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,边滴边用玻璃棒搅拌,继续煮沸 |
制备Fe(OH)3胶体 |
| D |
将铜片和锌片用导线连接后同时插入稀硫酸溶液中 |
比较锌和铜的金属活泼性 |