常温下有0.1 mol·L-1四种溶液NaOH、NH3·H2O、HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为 ,由水电离的c(H+)= mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线 ,a、b两点中,导电能力更强的是 。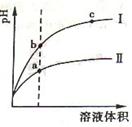
(3)NH3·H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(用离子方程式表示) 。此时,该混合溶液中的微粒浓度关系正确的是 。
| A.c(Cl-)>c(H+) >c(NH4+)>c(OH-) | B.c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| C.c(NH4+)+ c(NH3·H2O)= 0.1mol·L-1 | D.c(H+) = c(NH3·H2O)+c(OH-) |
(4)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH= ,该混合液中加入少量的酸或碱,结果发现溶液的pH变化不大,其原因是 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几
种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积),回答下列问题:
(1)混合物中是否存在FeCl2___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4___(填“是”或“否”),你的判断依据是。
(3)写出反应④的离子反应式:。
(4)请根据计算结果判断混合物中是否含有AlCl3__(填“是”或“否”),你的判断依据是。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是,还原剂是,每生成lmolNa2FeO4转移mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用,
。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:。
②每生成1mol FeO42- 转移mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH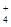 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO 、AlO 、AlO |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
①该溶液中一定含有的阳离子是______________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示, 分析后回答下列问题:
| Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
| n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
| n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
| n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、CuCl2中的一种或几种组成,
现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在CuCl2(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4(填“是”或“否”),你的判断依据是。
⑶写出反应③中的离子方程式
。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
___________________________________________________________________________。
绿原酸( )是一种抗氧化药物,存在下图转化关系。
)是一种抗氧化药物,存在下图转化关系。
(1)绿原酸中的含氧官能团有:酯基、。
(2)B的分子式是。
(3)A和B在一定条件下反应形成绿原酸的反应类型是。
(4)C的氧化产物能发生银镜反应,则C→D的化学方程式是。
(5)F是A的同分异构体。F可以与碳酸氢钠溶液反应产生气体,也可以与新制Cu(OH)2反应产生砖红色沉淀;F的苯环上只有两个取代基,符合上述条件F的结构简式(任写一种)。