下列离子方程式书写正确的是
| A.NH4HSO3溶液与过量的NaOH溶液混合:NH4++OH- =NH3·H2O |
| B.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- = 5SO42- + 2Mn2+ +3H2O |
| C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+= CO2↑+H2O |
| D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-= 2Fe2++I2 |
某反应吸热(ΔH>0),在常温下能自发进行,则该反应的ΔS
| A.可能大于0 | B.可能小于0 | C.肯定大于0 | D.肯定小于0 |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指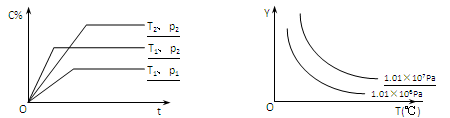
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.1molAl3+离子含有的核外电子数为10NA |
| B.1molCl2与足量的铁反应,转移的电子数为3NA[来 |
| C.10LpH=1的硫酸溶液中含有的H+离子数为2NA |
| D.10LpH=13的NaOH溶液中含有的OH-离子数为NA |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
| A.1 : 1 | B.2 : 1 | C.1 : 10 | D.10 : 1 |