已知温度T℃时水的离子积常数为Kw,该温度下,将浓度为a mol∙L−1的一元酸HA与b mol∙L−1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a = b | B.混合溶液中,c(H+)= 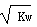 mol∙L−1 mol∙L−1 |
| C.混合溶液的pH=7 | D.混合溶液中,c(H+)+ c(B+) = c(OH-)+ c(A-) |
某有机物(化学式为C8H10O)有多种同分异构体,其中属于芳香醇的同分异构体一共有
| A.6种 | B.5种 | C.4种 | D.3种 |
下图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确的是
| A.离子半径比较:W>R>X>Y>Z |
| B.W的气态氢化物的还原性和稳定性均弱于R的氢化物 |
| C.工业上电解熔融的ZR3制备Z单质 |
| D.含Y元素的盐溶液可能显示酸性 |
常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
A.物质的量浓度相同的①CH3COONa ②NaClO ③NaOH三种溶液c(OH—)大小:③>②>①
B.往氯化铵溶液中加水, 的值变大
的值变大
C.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则充分反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.Ca(ClO) 2溶液中通入少量CO2,溶液的导电性和酸性均增强
下列实验操作正确且能达到目的的是
| A.用NH4Cl溶液蒸干制备NH4Cl固体 |
| B.用重结晶法除去KNO3中混有的NaCl |
| C.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
| D.用NaOH溶液和分液漏斗萃取溴水中的溴 |
一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2→2CO2 +3H2O,电池示意如图,下列说法正确的是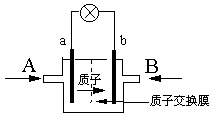
| A.A处通氧气,B处通乙醇 |
| B.电池工作时电子由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:O2+2H2O+4e-=4OH— |
| D.若用这种电池作电源保护金属铁,则a电极连接石墨,b连接铁 |