(选做题12分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用 。
(3)Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式 。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是 。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2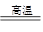 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 Kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
(6*1分)某溶液中含有SO42-、CO32-、Cl-三种阴离子。如果每次只检验一种离子,要↑
(1)先检验CO32-,加入试剂(或溶液),反应的离子方程式为;
(2)然后检验SO42,加入试剂(或溶液),反应的离子方程式为;
(3)最后检验Cl-,加入试剂(或溶液),反应的离子方程式为。
(4*2分)(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目。
(2)2.8gCO的物质的量为mol,含有个原子,
完全与氧化铜反应时失去电子mol。
(12分,每空3分)已知A为金属单质,C为一种强碱。它们有以下相互转化。试回答: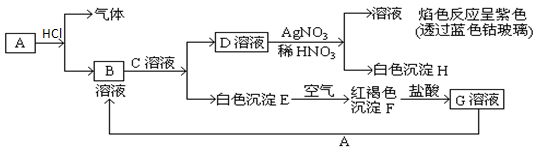
(1)写出B的化学式,D的化学式。
(2)写出由D转变成H的化学方程式。
(3)写出向G溶液加入A的有关离子反应方程式。
(12分)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究.下列各组物质中有一种物质与其它物质不属于同一类,按(例)所示,请将其挑出来,并说明理由。
| 物质组 |
不属于同一类的物质 |
理由 |
| (例)Mg、O2 、N2、NO |
Mg |
固体 |
| (1)NaOH、Na2CO3、CH4、KCl |
||
| (2)H2CO3、H2SO4、NH3·H2O、H2SiO3 |
||
| (3)CaO、SO2 、CO2、SiO2 |
(12分)
向一个固定体积的密闭容器充入2 mol A和1 mol B,发生如下反应:
2A(g) + B(g)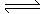 3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
3C(g) + D(g),2分钟后,反应达到平衡,C的浓度为1.2 mol/L。
(1)平衡后继续向容器中充入惰性气体,平衡_________移动。(填“正向”,“逆向”,“不”)
(2)用A表示2分钟内平均反应速率,A在第1分钟平均速率第2分钟平均速率(填“<”、“>”、“=”)。
(3)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为________(填“吸热”或“放热”)反应。
(4)为了增大B的转化率,可采取的措施是_________(用序号填空)
①加入A
②加入B
③加压
④再加入1.6 mol A+ 0.8 mol B
⑤将C分离出容器
(5)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是_________(用序号填空)
①4 mol A + 2 mol B
②3mol C + 1 mol D + l mol B
③3 mol C + 2 mol D
④1.6 mol A+ 0.8 mol B + 0.6 mol C + 0.2 mol D