湿法炼锌的冶炼过程可用如图简略表示:

请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是 .
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 .
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 .
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 .



(6)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 ________(填写选项编号).
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 ________(填写选项编号).
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(7)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,恒温恒容密闭容器中,下列依据能说明该反应达到平衡状态的是 .
CO(NH2)2(l)+H2O(g) △H<0,恒温恒容密闭容器中,下列依据能说明该反应达到平衡状态的是 .
A、容器中气体密度不变
B、容器中气体压强不变
C、n(NH3):n(CO2)=1:2
D、单位时间内消耗1molCO2,同时消耗1molH2O
E、容器内温度保持不变
(8)某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,发生2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)反应,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________.上图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应从开始至平衡时的曲线。
CO(NH2)2(l)+H2O(g)反应,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________.上图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应从开始至平衡时的曲线。

已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体。有关物质间的转化关系如下(图中部分反应物或产物已省略):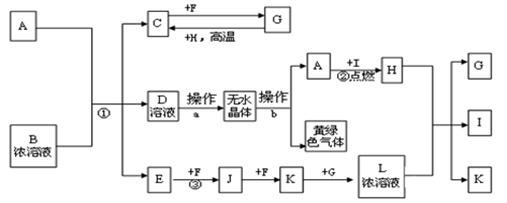
请填空
(1)B的电子式,B物质的水溶液呈,原因是(用离子方程式表示)
(2)反应①的离子反应方程式为
(3)操作a必须在HCl气流中加热得无水物,其原因是;操作b为
(4)K+G+F→L写出该反应的化学方程式,
(5)已知C的燃烧热为286KJ/mol,请写出表示1g C在F中完全燃烧生成液体G的热化学反应方程式。
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容。
(1)请写出实验室制取NH3的化学方程式;
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因
(用离子方程式和简要的文字说明);
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的_________,若外界条件为标准状况,所得氨水的物质的量浓度为________;
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理。设计成NH3—O2燃料电池,碱性条件下该电池负极电极反应为:。
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点。“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺。
Ⅰ、热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,在温度和容积相同的A、B、C三个容器中(容器的体积为2L),按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 |
A |
B |
C |
| 反应物投入量 |
1molCO2(g)和 3molH2(g) |
1molCH3OH(g)和 1molH2O(g) |
2molCO2(g)和 6mol H2(g) |
| CH3OH(g)浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应能量变化 |
放出29.4 kJ |
吸收a kJ |
放出b kJ |
①从反应开始到达平衡时,A中用CO2来表示的平均反应速率为mol/(L· s)(用具体数值表示);
②a=。c1c2 1/2c3(填“>”“<”或“=”)。
Ⅱ、CO可用于合成甲醇。在压强0.1MPa条件下,向体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示:
CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示: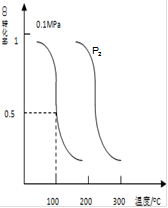
(1)该反应属于反应(填“吸热”或“放热”);P20.1MPa(填“>”“<”或“=”);
(2)100℃时,该反应的平衡常数K=(用含a、b的代数式表示)。
Ⅲ、碳一化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质。CO与NO在催化剂的条件下反应如下:2NO(g)+2CO(g)⇌2CO2(g)+N2(g) △H<0,在绝热、恒容的密闭容器中加入一定量的NO和CO发生上述反应,下列示意图不能说明反应在进行到t1时刻达到平衡状态的是(填字母序号)。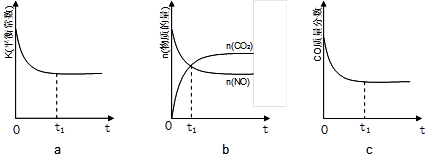
草酸(H2C2O4)是二元中强酸,酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。
Ⅰ、某探究小组利用该反应,用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为。
(2)滴定过程中操作滴定管的图示正确的是。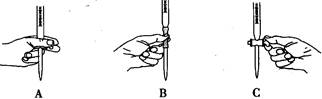
(3)本滴定达到终点的标志是:;
(4)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度,(填“偏高”、“偏低”、或“不变”)。
Ⅱ、草酸氢钠溶液显酸性,常温下,向10 mL 0.01mol/LNaHC2O4溶液中滴加0.01mol/LNaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是:。
| A.V(NaOH)=0时,c(H+)= 1×10-2 mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)= 1×10-7 mol/L |
| D.V(NaOH)>10mL时, c(Na+)> c(C2O42-)> c(HC2O4-) |
I.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g) +2B(s)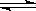 yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: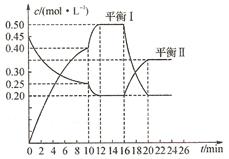
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率V(A)=_______。
(2)推测第10 min引起曲线变化的反应条件可能是_____(填序号,下同);第16 min引起曲线变化的反应条件可能是______。
①减压②增大A的浓度③增大C的量
④升温⑤降温⑥加入催化剂
(3)若平衡I的平衡常数为K1,平衡II的平衡常数为K2,则K1______K2(填“>”、“=”或“<”)。
II.如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。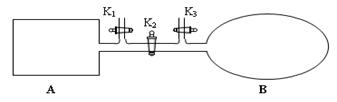
①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______(填 “变大”“变小”或“不变”)。
③若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。