某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)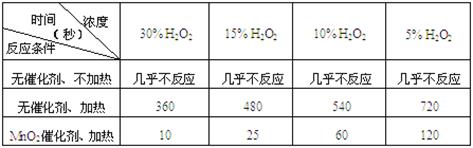
①该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响: 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式 _______________ ______。
②实验结果说明催化剂作用的大小与________ _________有关。
写出下列过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________
②电解法冶炼铝____________________________________________
③ NaH溶于水产生H2_______________________________________
简要回答下列问题
(1)以淀粉为原料生产葡萄糖的水解过程中,可用什么方法来检验淀粉的水解是否完全?
_______________________________________________________。
(2)成熟苹果的汁液能与银氨溶液发生反应,试解释原因。
_______________________________________________________。
(3)如何鉴别蚕丝和人造丝(纤维素)织物?
_______________________________________________________。
(4)乙醇和乙酸的官能团的名称分别是什么?
_______________________________________________________。
城市居民使用的管道气体燃料中,有天然气(主要成分是 )和“煤气”(主要成分是
)和“煤气”(主要成分是 和
和 )。它们燃烧反应的化学方程式如下:
)。它们燃烧反应的化学方程式如下:
试判断:
(1)燃烧相同体积的管道煤气和天然气,消耗氧气体积较大的是哪种?____________。
(2)适用于管道煤气的灶具在改为用于天然气时,需将进风口改大还是改小?如不改造进风口,可能产生什么不良后果?_____________________________________。
(3)管道煤气中除 和
和 外,还含少量甲烷、乙烷、丙烷、丁烷(沸点:-0.5℃)等气态烃,请解释为什么在严寒的冬季,管道煤气有时会出现火焰变小或断续现象。
外,还含少量甲烷、乙烷、丙烷、丁烷(沸点:-0.5℃)等气态烃,请解释为什么在严寒的冬季,管道煤气有时会出现火焰变小或断续现象。
___________________________________________________________。
书写化学方程式,并注明反应类型
(1)甲烷和氯气反应生成一氯甲烷_______________________________________。
(2)乙烯和溴水反应_______________________________________。
(3)苯和液溴在溴化铁催化下反应_______________________________________。
(4)由丙烯(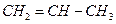 )合成聚丙烯_______________________________________。
)合成聚丙烯_______________________________________。
(5)乙醇和乙酸在浓 催化并加热条件下反应________________________。
催化并加热条件下反应________________________。
下列物质中,互为同位素的是(填序号,下同),互为同素异形体的是,互为同系物的是,互为同分异构体的是。
①金刚石; ②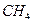 ; ③
; ③ ; ④
; ④ ;⑤
;⑤
⑥石墨; ⑦ ; ⑧
; ⑧