对可逆反应N2 (g)+3H2(g)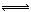 2 NH3(g) △H=-92.4 kJ·mol-1,下列叙述正确的是
2 NH3(g) △H=-92.4 kJ·mol-1,下列叙述正确的是
| A.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 |
| C.达到化学平衡时,2v正(H2)=3v逆(NH3) |
| D.加入催化剂,正反应速率增大,逆反应速率不变 |
将4 mol A 气体和2 mol B 气体在2 L 的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g),若经2 s(秒)后测得C的浓度为0.6 mol·L-1 ,现有下列几种说法,其中正确的是
2C(g),若经2 s(秒)后测得C的浓度为0.6 mol·L-1 ,现有下列几种说法,其中正确的是
| A.用物质A 表示的反应的平均速率为0.3 mol·L-1·s-1 |
| B.用物质B 表示的反应的平均速率为0.6 mol·L-1·s-1 |
| C.2 s 时物质A的转化率为70% |
| D.2 s 时物质B的浓度为0.7 mol·L-1 |
在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
下列事实不能用勒沙特列原理解释的是
A.合成氨反应:N2(g)+3H2(g) 2NH3(g);△H<0,为使氨的产率提高,理论上应采取低温高压的措施 2NH3(g);△H<0,为使氨的产率提高,理论上应采取低温高压的措施 |
B.对2HI(g) H2(g)+I2(g)平衡体系增加压强使颜色变深 H2(g)+I2(g)平衡体系增加压强使颜色变深 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
D.已知反应2NO2(g) N2O4(g),红棕色气体NO2加压后颜色先变深后变浅 N2O4(g),红棕色气体NO2加压后颜色先变深后变浅 |
大气臭氧层的反应是:O+O3=2O2 ΔH,该反应的能量变化如图所示,下列叙正确的是 
| A.O+O3=2O2是吸热反应 |
| B.O+O3=2O2是放热反应 |
| C.反应O+O3=2O2的ΔH=E3-E2 |
| D.反应O+O3=2O2的ΔH=E3-E1 |
在一固定容积的密闭容器中加入2molX和3molY气体,发生如下反应:nX(g)+3Y(g) 2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为
2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为
| A.1 | B.2 | C.3 | D.4 |