设NA为阿伏加德罗常数的值。下列说法正确的数量为
①1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
②78 g 苯含有C="C" 双键的数目为3NA
③常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
④标准状况下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
⑤常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
⑥1mol甲醇中含有C—H键的数目为4NA
⑦25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
⑧标准状况下,2.24 L已烷含有分子的数目为0.1NA
⑨常温常压下,18 g H2O 中含有的原子总数为3NA
⑩标准状况下,0. 1 mol Cl2溶于水,转移的电子数目为0.1NA
| A.1个 | B.2个 | C.3个 | D.4个 |
下列各组原子中,彼此化学性质一定相似的是
| A.最外层都只有一个电子的X、Y原子 |
B.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的 Y原子 Y原子 |
| C.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| D.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节能诱发关节疼痛,其化学机理为:①HUr(尿酸)+H2O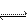 Ur— (尿酸根离子)+H3O+;②Ur— (aq)
Ur— (尿酸根离子)+H3O+;②Ur— (aq) +Na+ (aq)
+Na+ (aq)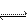 NaUr(s)。下列对反应②的叙述中正确的是
NaUr(s)。下列对反应②的叙述中正确的是
| A.反应的ΔH>0 | B.升高温度,平衡向正反应方向移动 |
| C.反应的ΔH<0 | D.降低温度,平衡向逆反应方向移动 |
下列有关说法错误的是
| A.P、S、Cl元素的最高化合价依次升高 |
| B.H2O、NH3、CH4分子的中心原子均为SP3杂化轨道类型 |
| C.Na、K、Rb第一电离能逐渐增大 |
| D.N、O、F电负性依次增大 |
MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
| A.c(M+)>c(A-)>c(H+)>c(OH-) | B.c(M+)>c(OH-)>c(A-)>c(H+) |
| C.c(M+)>c(H+)>c(A-)>c(OH-) | D.c(M+)>c(A-)>c(OH-)>c(H+) |
下列离子方程式不正确的是
| A.碳酸氢钠溶液与足量石灰水反应:HCO3- + Ca2+ + OH-=CaCO3↓ + H2O |
| B.鸡蛋壳在醋酸溶液中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
C.电解CuSO4溶液:2Cu2+ + 2H2O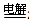 2Cu + O2↑+ 4H+ 2Cu + O2↑+ 4H+ |
D.亚硝酸钠水溶液显碱性:NO2-+H2O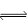 HNO2+OH- HNO2+OH- |