锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下: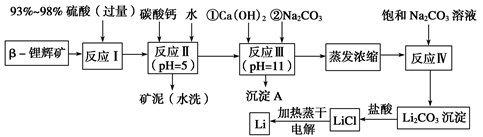
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:__________________________。
(2)反应Ⅱ加入碳酸钙的作用是__________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:________________________。
(4)洗涤所得Li2CO3沉淀要使用________(选填“热水”或“冷水”),你选择的理由是__________________________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是
________________________________________。
根据所学知识填空:
(1)3.01×1023个OH-中含有质子的物质的量为mol,含电子的数目为,与molNH3具有相同的质量。
(2)同温同压下,气体A与氧气的质量比为1∶2,体积比为1∶4,气体A的摩尔质量是
(3)在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为
在标准状况下CH4和过量O2的混合气体840ml,点燃充分反应后,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.6g。试计算:
(1)经碱石灰吸收后所剩余气体体积(标准状况下)
(2)原混合气体中CH4的体积分数
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
(1)请写出B极板的名称: 电极反应式
写出电解时反应的总离子方程式
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)=" 2.0mol/L" ;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。
则原溶液中的c(K+)=
同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区别这些
概念吗?下面列出了几组物质,请将物质的合适组号填写在下表中。
① 和
和 ; ②
; ② 和
和 ;
;
③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
| 类别 |
同位素 |
同系物 |
同素异形体 |
同分异构体 |
| 组号 |
22.如图示实验中,把四根洁净的金属条A、B、C、D轮流放置在没有盐溶液的滤纸上面并压紧。在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如右表)。
(1)金属可能是最强的还原剂;
(2)金属不能从硫酸铜溶液中置换铜。