黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400 ℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式__________________。K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是__________________。
(2)CN-中碳原子的杂化方式为____________;1 mol CN-中含有π键的数目为__________。
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为______________。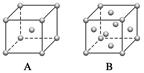
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为________________。
(12分)硫酸工业尾气中二氧化硫的含量超过0 .05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。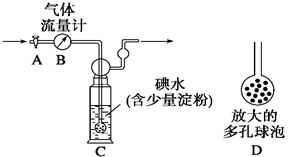
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
【乙方案】:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式___________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是.
_________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
(10分) 根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):

⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式:。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:、。
⑶写出Cl2将Z氧化为K2EO4的化学方程式:。
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有种峰,错误的结构有种峰。
(12分)甲、乙、丙、丁四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
Cl-、SO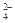 、NO3-、OH- 、NO3-、OH- |
现进行以下实验,
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀; ②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出下列物质的化学式:甲乙
(2)丙的阴离子的电子式是,丁的阳离子的结构示意图是;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合:
②乙溶液与丁溶液混合:
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。
(1)光导纤维是一种能高质量传导光的玻璃纤维,利用光缆通讯,能同时传输大量信息。制造光纤电缆的主要原材料的化学式是____
(2)信息产业的核心材料是高纯度的硅,高纯度的单晶硅生产方法之一:
SiO2 Si(粗硅)
Si(粗硅) SiHCl3(沸点31.5℃)
SiHCl3(沸点31.5℃) Si
Si 超纯硅(多晶硅)
超纯硅(多晶硅) 单晶硅
单晶硅
近代用得较多的另一种方法(之二)是:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。根据上述信息回答以下问题:
从方法一生产单晶硅的过程看,由碳还原得到的硅为何还要进一步处理?

(3)写出方法二中,生产高纯硅的两个化学反应方程式:
①_____________________。②______________
10分)阅读下表中部分短周期主族元素的相关信息,请回答:
| 元素代号 |
相关信息 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期的所有金属离子中,Y的离子半径最小 |
| Z |
Z与Y同周期,是所在周期中原子半径最小的元素 |
| T |
T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为,该化合物中所含的化学键有______(填化学键名称)。
(2)单质T与冷水反应的化学方程式为
(3)将Y与Z形成的化合物的水溶液,逐滴加入到T的最高价氧化物对 应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式
应水化物的溶液中直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式 , .
, .