根据下面的反应路线及所给信息填空。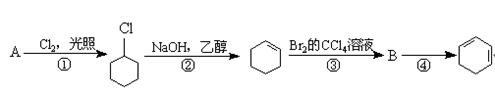
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ;②的反应类型是 。
(3)反应④的化学方程式是 。
Ⅰ下列说法不正确的是____。
| A.可以利用某些炼钢废渣来生产磷肥 |
| B.具有永久硬度的水主要用加热的方法来进行软化 |
| C.硫酸工业中,在接触室安装热交换器是为了利用S03转化为H2S04时放出的热量 |
| D.合成氨工业原料气净化时,常用碳酸钾溶液吸收除去二氧化碳 |
Ⅱ下图是某工厂对海水资源进行综合利用的示意图。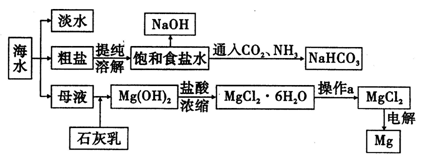
请回答下列问题:
(1)用离子交换膜电解饱和食盐水时,精制的饱和食盐水应该加入到极室。
(2)已知在离子交换膜电解槽中,理论上每小时通过1安培的直流电,每槽可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342×103 kg/m3)113 m3,电解槽的电流强度1.45×l04 A,该电解槽的电解效率为。
(3)示意图中制取NaHC03的化学方程式为。
(4)有人提出直接加热Mg(OH)2得到Mg0,再电解熔融Mg0得金属Mg,这样可简化流程。请判断该方案是否可行,并说明理由。
下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。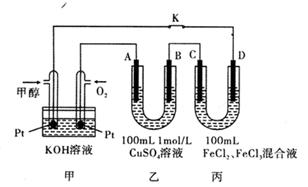
(1)甲中负极的电极反应式为____。
(2)乙中A极析出的气体在标准状况下的体积为____。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系右图,则图中②线表示的是离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要mL 5.0 mol/L NaOH溶液。
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度(×10—3 mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①氨基甲酸铵分解反应的焓变△H 0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。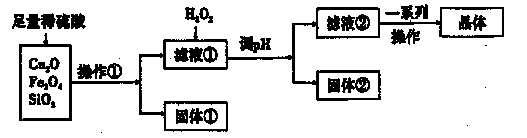
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为。
(4)调pH可选用的药品为____。
| A.NaOH溶液 | B.CuO | C.氨水 | D.CuCO3 |
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是。
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。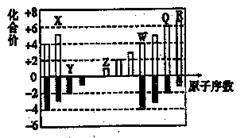
(1)元素Q位于周期表中第周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。