U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1)Z元素在周期表中的位置______________ 。W、X、Y、Z四种元素的原子半径由小到大的顺序是______________ (用元素符号表示)。
(2)用电子式表示U与X形成的18电子化合物的形成过程________ 。
(3)ZX2与NaOH溶液反应的离子方程式 。
(4)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是______________,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共aL(标准状况),则 Y 单质的质量是______________ g(用含a的代数式表示)。
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:__________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:_________________________
________________________________________________________________________。
(3)写出下列物质的电子式:
①D元素形成的单质:________________________________________。
②E与B形成的化合物:_____________________________________。
③A、B、E形成的化合物:________________________________________。
④D与E形成的化合物:________________________________________。
⑤C、D、E形成的离子化合物:______________________________________。
以下列出了四种物质的分子结构示意图。其中圆圈表示原子核(包含除价电子以外的电子)的示意图,黑点表示非共用电子对,直线表示共价键,且图中各分子仅是由第一、二周期元素的原子构成的。在括号内填写四种物质的分子式。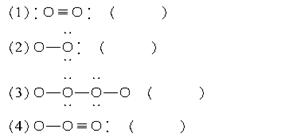
a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)________________________;b的氢化物和b的最高价氧化物对应的水化物反应生成Z,则Z的化学式为________,d、e形成化合物的电子式为________________。
(3)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为________________。
有A、B、C三种元素,已知①4 g A元素的单质与水作用,在标准状况下放出氢气2.24 L,反应中有1.204×1023个电子发生转移;②B元素可与A元素形成AB2型的离子化合物,且知A、B的离子具有相同的核外电子排布;③元素C的气态氢化物可以与其最高价氧化物对应的水化物发生非氧化还原反应生成盐,1 mol该盐含有42 mol电子。
根据以上信息填写下列空白:
(1)元素符号:A:________,B:________,C:________。
(2)A元素的离子结构示意图为__________________________________________。
(3)用电子式表示AB2的形成过程__________________________________
________________________________________________________________________。
(4)C的气态氢化物与B的气态氢化物反应时有________________现象发生,生成物的化学式为________,它属于________化合物。
A+和B2-都与Ar具有相同的电子层结构,则A的元素符号为________,B元素的原子结构示意图为____________,它们形成的化合物的电子式为________________,A+和B2-离子半径大小比较为________________。