焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是 。
(14分)甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成。常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物。试回答下列问题:
(1)甲的结构式。
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为(写化学式)。16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为。
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式。
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液。
①写出其离子方程式。
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如下图)。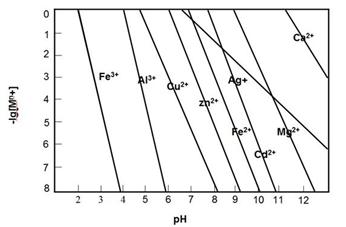
③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
[化学—选修5:有机化学基础](15分)
(15)蓓萨罗丁(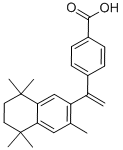 )是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):
)是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):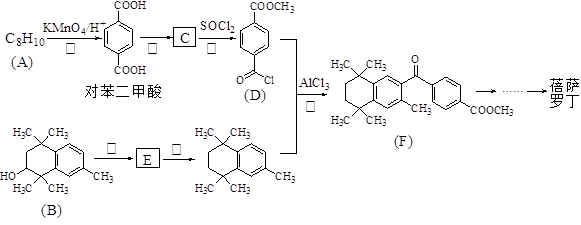
已知:Ⅰ. 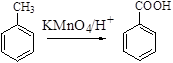 Ⅱ.
Ⅱ.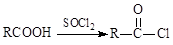
试回答下列问题:②③⑥
(1)蓓萨罗丁的分子式是; F分子中官能团的名称为、。
(2)原料A的核磁共振氢谱的峰面积之比为;原料B发生反应④所需的条件为。
(3)反应①~⑥中属于的取代反应类型的有(填序号)。
(4)E物质具有的性质是__________________。
a. 属于芳香烃
b.与Br2在不同条件下既能发生加成反应,也能发生取代反应
c.与酸性高锰酸钾反应,化学键只一处断裂
(5)反应②的化学方程式分别为__________________________。
(6)对苯二甲酸有多种同分异构体,写出符合下列条件的同分异构体的结构简式。
①苯环上有三个取代基,且均匀分布;②能与浓溴水发生沉淀反应;③能发生银镜反应。
【物质结构与性质】
碳元素可以组成不同的单质和化合物。
(1)碳原子的电子排布图为_______________
(2)由C和同周期的元素组成的分子如图a,推测分子式是____________,键角为_______。 图a
图a
(3)CO2分子的结构式为__________,与它等电子体的分子有___________;
(4)第ⅡA金属碳酸盐分解温度如下:
| BeCO3 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
| 分解温度 |
100℃ |
540℃ |
960℃ |
1289℃ |
1360℃ |
碳酸盐中CO碳原子是________杂化,其空间构型为________________。
解释上列碳酸盐分解温度越来越高的原因是_________________________。
(5)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图2 晶胞结构,化学式为____________________。Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
在晶胞中,给出的平行六面体的棱长单位为nm,相对原子质量Li:7、C:12。
则锂电池负极材料的密度为_____________g·cm-3(用含a、b代数式表示)。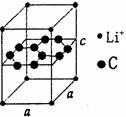
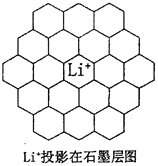
图2图3
【化学一选修2:化学与技术】(15分)
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2="==" SnCl +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________;b.沉淀:_____________________________;
c.分离,洗涤;d.烘干,研磨。
(15分)铜的氯化物是重要的化工原料,广泛地用作有机合成催化剂。
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。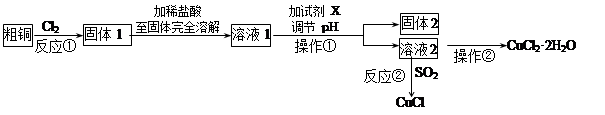
按要求回答下列问题:
(1)操作①的玻璃仪器有________________________,检验溶液2中是否含有杂质离子的操作是。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是;
溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)___________。
a.NaHCO3 b.NH3·H2O c.CuO d.Cu2(OH)2CO3
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式:。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
①按气流方向连接各仪器接口顺序是:a→、 → 、 → 、 → 。实验大试管加热前要进行一步重要操作,其操作是。
②反应时,盛粗铜粉的试管中的现象是。