根据下列框图,有关说法正确的是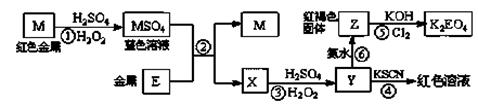
| A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O ==3EO4 2―+ 6Cl― +12H+ |
| C.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42―+4H2O+3e-="=" E(OH)3+5OH― |
| D.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 |
向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+ 3OH- Cr(OH)3(灰蓝色)
Cr(OH)3(灰蓝色) CrO2-(绿色)+ H+ + H2O。将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
CrO2-(绿色)+ H+ + H2O。将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液。a、b试管中溶液颜色最终分别为
| 选项 |
A |
B |
C |
D |
| a试管 |
紫色 |
蓝灰色 |
绿色 |
蓝灰色 |
| b试管 |
绿色 |
绿色 |
紫色 |
紫色 |
下列说法错误的是
| A.NH4NO3溶于水虽然吸热,但其溶于水是自发过程 |
| B.加热液体(温度高于沸点)会自发转变成气体,可用焓判据解释 |
| C.对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值通常最小 |
| D.正确判断化学反应能否自发进行,要综合考虑反应的ΔH和ΔS |
工业通过氨的催化氧化制取硝酸,其中一个反应3NO2(g) + H2O(l) 2HNO3(aq) + NO(g)ΔH < 0,现欲提高反应物NO2的转化率,增加硝酸的产量,下列采取的措施可行的是
2HNO3(aq) + NO(g)ΔH < 0,现欲提高反应物NO2的转化率,增加硝酸的产量,下列采取的措施可行的是
| A.增加压强 | B.加大水量 | C.升高温度 | D.加入催化剂 |
对一已经达到化学平衡的体系,下列说法正确的是
| A.化学反应速率变化时,化学平衡一定发生移动 |
| B.化学平衡发生移动时,化学反应速率一定变化 |
| C.正反应进行的程度越大,正反应速率一定越大 |
| D.使化学反应速率发生变化,而化学平衡不移动的影响因素,一定是催化剂 |
已知反应N2(g) + 3H2(g) 3NH3(g)ΔH < 0,能增大正反应速率的措施是
3NH3(g)ΔH < 0,能增大正反应速率的措施是
| A.通入N2 | B.扩大容器容积 | C.移去部分NH3 | D.降低体系温度 |