3.04 g铜镁合金完全溶解于100mL密度为1.40g•mL-1、质量分数为63%的浓硝酸中,得到NO2 和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.00 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。下列说法不正确的是
| A.得到5.08g沉淀时,加入NaOH溶液的体积是600mL |
| B.该合金中铜与镁的物质的量之比是2:l |
| C.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1 |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g)(正反应是放热反应)。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g)(正反应是放热反应)。为了使平衡向生成Z的方向移动,应选择的条件是
①增加X ②降低温度 ③增大压强 ④降低压强⑤加入正催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑥ | C.②③⑤ | D.②④⑥ |
在一密闭容器中进行以下可逆反应:M(g)+P(g) N(g)+2 L。在不同的条件下P的百分含量P%的变化情况如图,则该反应
N(g)+2 L。在不同的条件下P的百分含量P%的变化情况如图,则该反应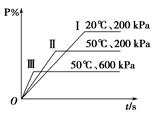
| A.正反应放热,L是固体 | B.正反应吸热,L是气体 |
| C.正反应吸热,L是固态 | D.正反应放热,L是固体或气体 |
在密闭容器中进行反应X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Y2为0.1 mol·L-1 | B.X2为0.1 mol·L-1 |
| C.Y2为0.35 mol·L-1 | D.Z为0.3 mol·L-1 |
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是
| A.醋酸的浓度达到1 mol·L-1 |
| B.H+的浓度达到0.5 mol·L-1 |
| C.醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol·L-1 |
| D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等 |
下列说法可以证明反应N2(g)+3H2(g) 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
| A.1个N≡N键断裂的同时,有3个H—H键形成 |
| B.1个N≡N键断裂的同时,有3个H—H键断裂 |
| C.N2、H2、NH3的分子数之比为1∶3∶2 |
| D.1个N≡N键断裂的同时,有6个H—N键形成 |