在同温同压下,合成氨反应N2+3H2=2NH3进行到某时刻达到平衡.起始时N2和H2共120体积,平衡时总体积为70体积,则原混合气体中N2和H2的体积比可能为:
| A.1:3 | B.9:15 | C.5:19 | D.1:1 |
下列说法中正确的是( )
A. 在FeBr3催化作用下与液溴反应生成的一溴代物有4种 在FeBr3催化作用下与液溴反应生成的一溴代物有4种 |
B.1mol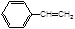 可以和4mol氢气加成 可以和4mol氢气加成 |
C. 和 和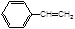 是同系物 是同系物 |
D. 分子中所有原子都处于同一平面 分子中所有原子都处于同一平面 |
下列关于有机化合物的说法不正确的是()
| A.鸡蛋清中加浓硝酸微热后变黄 |
| B.将苯滴入溴水中,振荡后水层接近无色 |
| C.蛋白质水解能得到氨基酸 |
| D.苯与乙醇都能使高锰酸钾溶液褪色 |
有关天然物质水解叙述不正确的是 ( )
A氨基酸既显酸性有显碱性
B.可用碘水检验淀粉是否水解完全
C.变质的油脂有难闻的气味,是由于油脂发生了水解反应
D.纤维素水解和淀粉水解得到的最终产物相同
化学与科学研究、日常生活有着密切联系,下列有关说法正确的是( )
| A.用酒精可以除去水壶中的水垢 |
| B.市场上的加酶洗衣粉去除蛋白质油渍效果很好,可以用来洗涤毛织品、棉织品及化纤织品 |
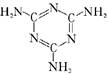
| C.三聚氰胺(结构如下图)的摩尔质量为l26g |
| D.真假毛线可以通过灼烧的方法进行鉴别 |
煤是工业的粮食,石油是工业的血液。下列关于煤和石油的说法中错误的是()
| A.石油裂解主要目的是得到短链的不饱和烃 |
| B.含C18以上烷烃的重油经过催化裂化可以得到汽油 |
| C.煤的气化与液化都是化学变化 |
| D.煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 |