现行中学教材中,有以下化学实验:
A.溴乙烷的水解
B.浓硫酸跟乙醇反应制乙烯
C.乙醛还原新制的氢氧化铜
D.乙酸乙酯的制取
E.石油的蒸馏
F.葡萄糖的银镜反应
G.乙酸乙酯的水解。
对以上实验,按下列各操作的要求,用字母A、B、C、——完成以下填空:(多填扣分)
(1)需用水浴加热的是 ;
(2)实验装置不需要检查气密性的是 ;
(3)为防止液体暴沸,常需加少量碎瓷片的是 ;
(4)需用温度计的是 。
实验室配制500ml 2mol·L-1的H2SO4溶液
(1)所需仪器应该有容量瓶、玻璃棒、量筒、________________、________________。
(2)容量瓶在使用前,首先应检查。
(3)此实验中,玻璃棒的两个作用分别是________________、________________。
(4)配制时,要用量筒量取密度为1.84g/cm3,质量分数为98%的浓硫酸_____________ml。
(5)若配好摇匀后,发现容量瓶中的液面略低于刻度线,问是否应该补充蒸馏水_________(填“应该”或“不应该”);若所用的容量瓶中事先有少量的蒸馏水,则对实验结果有无影响____________。(填“有影响”或“无影响”)
(8分)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表: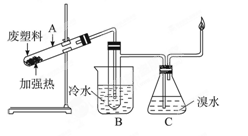
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。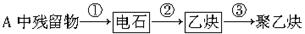
写出反应③的化学方程式: ____________________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有_____种。
(3)锥形瓶C中观察到的现象______________。
(4)写出C中逸出的气体在工业上的两种用途:________________、_______________。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如下图所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为________________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)________;
| A.Ⅳ比Ⅲ复杂 |
| B.Ⅳ比Ⅲ安全 |
| C.Ⅳ比Ⅲ操作简便 |
| D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)________。
有下列化学仪器:①托盘天平,②玻璃棒,③药匙,④烧杯,⑤量筒,⑥容量瓶,⑦胶头滴管,⑧细口试剂瓶,⑨标签纸。
(1)现要配制500 mL、1 mol·L-1的硫酸溶液,需用质量分数为98%、密度为1. 84 g·cm-3的浓硫酸__________________mL。
(2)从上述仪器及标签纸中,按实验使用的先后顺序,其编号排列是___________
(3)容量瓶在使用前需要检验_____________。
(4)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“不变”)。
摇匀后发现液面低于刻度线再加水:_________容量瓶中原有少量蒸馏水:_______。
定容时俯视观察液面:___________
现有三组溶液:①汽油和水溶液②39%的酒精溶液⑧氯化钠和硝酸钾的水溶液,分离以上各混合液的正确方法依次是_________、___________、______________(填“过滤”、“萃取”、“分液”、“蒸馏”、“结晶”等)。