将1mol NaHCO3和1mol Na2O2固体混合,在加热的条件理使其充分反应,则最后所得固体为
| A.1mol Na2CO3和1mol NaOH | B.lmol Na2CO3和2molNaOH |
| C.2mol Na2CO3和2molNaOH | D.2mol Na2CO3 |
右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是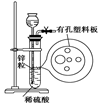
①食盐水②KNO3溶液③适量稀硫酸铜溶液
④Na2CO3溶液⑤CCl4⑥浓氨水
| A.①③⑤ | B.①②③ | C.④⑤⑥ | D.①②③⑤ |
下列有关物质性质、结构的表述均正确,且存在因果关系的是
| 表述1 |
表述2 |
|||
|
食品香精菠萝酯的生产路线(反应条件略去)如下: 下列叙述错误的是
下列叙述错误的是
| A.步骤①产物中残留的苯酚可用FeCl3溶液检验 |
| B.步骤②产物中残留的CH2=CHCH2OH可用溴水检验 |
| C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 |
| D.苯氧乙酸和菠萝酯均可与H2在一定条件下发生反应 |
NA代表阿伏加德罗常数,下列有关叙述正确的是
| A.1mol苯分子中含有碳碳双键数为3NA | B.1mol氯化氢分子中含H+ 离子数为NA |
| C.16 g CH4与18 g NH4+所含质子数均为NA | D.4.6 g钠与盐酸完全反应失去电子数为0.2NA |
根据下表信息,判断0.10mol/L的下列各溶液pH值最大的是
|
|