某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:Ka∶Kh=Kw
| A.①④ | B.①②④ | C.②③ | D.③④ |
在密闭容器中进行反应M(g)+N(g)  Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
Y(g)+2Z(?),产物Y在平衡混合物中的质量分数(Y%)不同温度、压强条件下随时间的变化如图所示,则下列叙述正确的是
| A.正反应为放热反应,Z是气体 |
| B.正反应为放热反应,Z是固体或液体 |
| C.正反应为吸热反应,Z是气体 |
| D.正反应为吸热反应,Z是固体或液体 |
四种短周期元素在元素周期表中的位置如右图所示,其中Z的原子半径最小。下列说法正确的是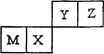
| A.M元素一定为金属元素 |
| B.X元素的最简单气态氢化物的热稳定性比Z元素的大 |
| C.若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 |
| D.Z元素与氢元素一定能形成原子个数比为1︰1的共价化合物 |
下列说法正确的是
| A.将盐酸和醋酸钠溶液混合后溶液呈中性,溶液中c(Na+)=c(Cl-) |
| B.1 mol CH4分子中含有的共价键数目等于1 mol Na2O2固体中含有的离子总数 |
| C.80℃的纯水的pH大于25℃的纯水的pH |
| D.等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数 |
已知可逆反应CO(g)+H2O(g)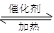 CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
| A.增大压强 | B.升高温度 | C.增大CO的浓度 | D.分离出CO2 |
下列离子方程式正确的是
| A.用Fe除去FeCl2溶液中的少量的FeCl3杂质:Fe+Fe3+=2Fe2+ |
B.实验室制取NO2:Cu+4H++2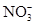 =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
C.硫酸溶液与氢氧化钡溶液混合:H++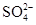 +Ba2++OH-=BaSO4↓+H2O +Ba2++OH-=BaSO4↓+H2O |
D.向氯化铝溶液通足量氨气:Al3++4NH3+4H2O=4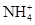 +[Al(OH)4]- +[Al(OH)4]- |