在一定条件下用NH3捕获CO2可以生成重要的有机化工产品——三聚氰酸,反应的化学方程式如下:
NH3+ CO2→  + H2O
+ H2O
下列有关三聚氰酸的说法正确的是
| A.分子式为C3H6N3O3 | B.分子中既含极性键,又含非极性键 |
| C.属于共价化合物 | D.生成该物质的上述反应为中和反应 |
下列说法不正确的是
| A.将足量澄清石灰水加入250mL碳酸氢钠溶液中,过滤、干燥后得到10g沉淀,则碳酸氢钠溶液的物质的量浓度为0.4mol·L-1 |
| B.人造纤维是利用自然界的非纤维材料通过化学合成方法得到的 |
| C.氮氧化物不但能形成酸雨,还能产生有毒的光化学烟雾 |
| D.太阳能以光和热的形式传送到地面,是地球上最基本的能源 |
下列有关化学用语错误的是
A.碳酸的二级电离方程式:H2O+HCO3- H3O++CO32- H3O++CO32- |
| B.玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为2CaO·5MgO·8SiO2·H2O |
| C.NaH与重水反应的方程式:NaH+D2O=NaOD+HD↑ |
| D.均含有NA个电子的H2O和CH4具有相同的体积 |
以下反应最符合绿色化学原子经济性要求的是
| A.乙烯聚合为聚乙烯高分子材料 |
| B.甲烷与氯气制备一氯甲烷 |
| C.以铜和浓硝酸为原料生产硝酸铜 |
| D.用SiO2制备高纯硅 |
用下图表示的一些物质或概念间的从属关系中不正确的是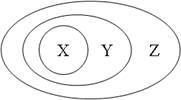
| X |
Y |
Z |
|
| A. |
铜 |
ds区元素 |
过渡元素 |
| B. |
明矾 |
盐 |
化合物 |
| C. |
胶体 |
分散系 |
混合物 |
| D. |
氧化钠 |
金属氧化物 |
碱性氧化物 |
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示。
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 |
CO32-、AlO2-、NO3- |
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如下图所示。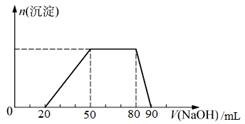
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示。
| Cl2的体积(标准状况) |
5.6L |
11.2L |
22.4L |
| n(Cl-) |
2.5mol |
3.0mol |
4.0mol |
| n(Br-) |
3.0mol |
2.8mol |
1.8mol |
| n(I-) |
X mol |
0 |
0 |
下列说法中错误的是
A.X=0.3
B.溶液中n(Cl-): n(Br-):n(I-)=10:15:4
C.加入的氢氧化钠溶液的浓度为1.45mol·L-1
D.溶液中大量存在的离子共有六种