化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH- |
| B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑ |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+ |
食品香精菠萝酯的生产路线(反应条件略去)如下,下列叙述错误的是( )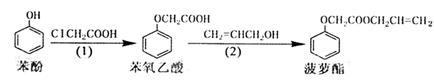
| A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验 |
| B.反应(1)和(2)均为取代反应 |
| C.苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应,均有酸性。 |
| D.与苯氧乙酸互为同分异构体,能使FeCl3溶液显紫色,并能发生水解反应但不发生银镜反应的芬香族化合物共有6种 |
霉酚酸(Mycophenolic acid)是一种生物活性化合物。下列有关霉酚酸的说法正确的是( )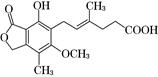
| A.一定条件下,1 mol霉酚酸最多可与3 mol H2反应 |
| B.处于同一平面的碳原子至多9个 |
| C.只有2个官能团 |
| D.分子式为:C17H20O6 |
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。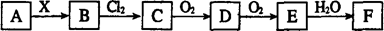
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
完全燃烧0.1 mol某饱和一元醛生成8.96 L(标准状况下)二氧化碳,则3.6 g该醛跟足量银氨溶液反应,生成固体物质的质量为( )
| A.10.8 g | B.7.2 g | C.9.4 g | D.11.6 g |
由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定),则这两种混合气体的可能组成是()
| A.C2H4、C3H8 | B.CH4、C5H8 | C.C2H6、C3H8 | D.CH4、C4H8 |