下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)=c(A-)
D.0.1 mol·L-1的 NaHA 溶液pH=1则有c(Na+)=c(H2A)+c(HA-)+c(A2-)
类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能知道其正确与否。以下几种类推结论中正确的是( )
| A.金属镁失火不能用二氧化碳灭火器扑灭;金属钠失火也不能用二氧化碳灭火 |
| B.加热Ag2O可以得到单质银;加热CuO也可制取单质铜 |
| C.工业上用电解熔融MgCl2的方法制取金属镁;故也可用电解熔融AlCl3的方法制取金属铝 |
| D.Al和S直接化合可以得到Al2S3;Fe与S直接化合也可得到Fe2S3 |
下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤Cu与HNO3溶液反应,由于HNO3浓度不同可发生不同的氧化还原反应
| A.都正确 | B.②③④⑤ | C.②③⑤ | D.④⑤ |
下列各组离子在指定条件下一定能大量共存的是( )
A.在加入铝粉能产生氢气的溶液中: |
B.能使淀粉碘化钾试纸变蓝的溶液中: |
C.能使红色石蕊试纸变蓝的溶液中: |
D.在含有大量Fe3+的溶液中: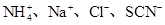 |
下列化学反应的离子方程式正确的是( )
| A.向稀盐酸溶液中加铁:3Fe+6H+=3Fe3++3H2↑ |
| B.FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| C.向氯化铝溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
D.向偏铝酸钠溶液中通入过量CO2: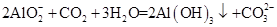 |
下列实验操作或对事实叙述正确的是( )
| A.某无色溶液焰色反应呈黄色,则其一定为钠盐溶液 |
| B.用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物 |
| C.加热法不可区分I2和KMnO4两种紫色固体 |
| D.只用水即可鉴别固体Na2CO3和NaHCO3 |